25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
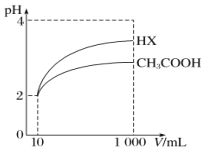
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
H2CO3 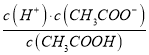 HCO3-
HCO3- CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
本题考查电离平衡常数、电离方程式的书写,(1)电离平衡常数越大,说明电离程度越大,三种酸酸性强弱的顺序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的电离:CH3COOH CH3COO-+H+,依据电离平衡常数的表达式,即Ka=
CH3COO-+H+,依据电离平衡常数的表达式,即Ka=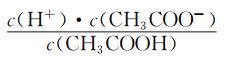 ;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3
;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3 H++HCO3-、HCO3-
H++HCO3-、HCO3- H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O H3O++CO32-,碳酸的第二步电离为:HCO3-
H3O++CO32-,碳酸的第二步电离为:HCO3- H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
