问题描述:
过氧化钙(CaO
2)是一种对环境友好的多功能物质,可用于水产养殖、水果保鲜等.温度过高过氧化物会分解生成氧化物和氧气.【制备】以下是一种制备过氧化钙的实验方法:
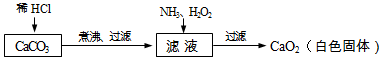
(1)煮沸的目的是___;(2)滤液中加入氨气、双氧水后发生反应:CaC1
2+H
2O
2+2NH
3═CaO
2+2___.【测定】过氧化钙中通常含有部分CaO杂质.请分析在过氧化钙样品中,钙元素的质量分数随杂质含量的增加而___(填“增大”、“减小”或“不变”)(3)为测定某过氧化钙样品的纯度,称取1.50g样品,充分加热使之完全分解,生成CaO和O
2,得到O
2的质量0.32g.计算该样品中过氧化钙的质量分数.
 最佳答案:
最佳答案: (1)气体的溶解度随着温度升高而减小,因此煮沸的目的是除去溶解在溶液中的二氧化碳、氯化氢等气体.故填:除去二氧化碳、氯化氢等气体.(2)由质量守恒定律可知,反应前后都是1个钙原子,反应前是2个氯原子,反应后应该是2个氯原子,包含在未知物质中,反应前是8个氢原子,反应后应该是8个,包含在未知物质中,反应前后都是2个氧原子,反应前是2个氮原子,反应后应该是2个,包含在未知物质中,因此未知物质中含有1个氮原子、4个氢原子和1个氯原子,未知物质是氯化铵,反应的化学方程式为:CaC12+H2O2+2NH3═CaO2+2NH4Cl.故填:NH4Cl.【测定】过氧化钙中钙元素质量分数=
×100%=55.6%,氧化钙中钙元素质量分数=
×100%=71.4%,因此在过氧化钙样品中,钙元素的质量分数随杂质含量的增加而增大.故填:增大.(3)设过氧化钙的质量为x,2CaO2
2CaO+O2↑,144 32x 0.32g
=
,x=1.44g,该样品中过氧化钙的质量分数为:
×100%=96%,答:该样品中过氧化钙的质量分数为96%.
 (1)煮沸的目的是___;(2)滤液中加入氨气、双氧水后发生反应:CaC12+H2O2+2NH3═CaO2+2___.【测定】过氧化钙中通常含有部分CaO杂质.请分析在过氧化钙样品中,钙元素的质量分数随杂质含量的增加而___(填“增大”、“减小”或“不变”)(3)为测定某过氧化钙样品的纯度,称取1.50g样品,充分加热使之完全分解,生成CaO和O2,得到O2的质量0.32g.计算该样品中过氧化钙的质量分数.
(1)煮沸的目的是___;(2)滤液中加入氨气、双氧水后发生反应:CaC12+H2O2+2NH3═CaO2+2___.【测定】过氧化钙中通常含有部分CaO杂质.请分析在过氧化钙样品中,钙元素的质量分数随杂质含量的增加而___(填“增大”、“减小”或“不变”)(3)为测定某过氧化钙样品的纯度,称取1.50g样品,充分加热使之完全分解,生成CaO和O2,得到O2的质量0.32g.计算该样品中过氧化钙的质量分数. 最佳答案:
最佳答案: 