氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)已知氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,请写出表示氢气燃烧热的热化学方程式___________________________;若断开H2(g)中1molH-H需要吸收436kJ的能量,生成H2O(g)中的1mol H-O键放出463 kJ的能量,18g液态水转化为水蒸气需要吸收44 kJ的能量,则断开1molO2中的共价键需要吸收___________kJ的能量。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的正极反应式:___
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______
(4)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
a.容器内气体压强保持不变
b. 1 mol MHx能够吸收ymol H2
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则c(H2)增大
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①请写出阳极电极反应式________________________
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,请分析在实验中控制NaOH浓度为14mol/L的原因:______________。
【答案】H2(g) +1/2O2(g)=H2O(l) ,ΔH=-285.8kJ.mol-1 496.4 O2 +2H2O +4e-=4OH- 太阳能转化为化学能 ac Fe+8 OH- -6e-=FeO42- +4H2O 防止Na2FeO4被H2还原 低于14mol/LNa2FeO4不稳定,高于14mol/LNa2FeO4转化为Fe(OH)3
【解析】(1)氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,则生成18g液态水放热57.16kJ×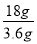 =285.8kJ的热量,表示氢气燃烧热的热化学方程式为H2(g) +1/2O2(g)=H2O(l) ΔH=-285.8kJ·mol-1;则H2(g) +1/2O2(g)=H2O(g) ΔH=-241.8kJ·mol-1焓变△H=反应物总键能-生成物总键能=436kJ·mol-1+
=285.8kJ的热量,表示氢气燃烧热的热化学方程式为H2(g) +1/2O2(g)=H2O(l) ΔH=-285.8kJ·mol-1;则H2(g) +1/2O2(g)=H2O(g) ΔH=-241.8kJ·mol-1焓变△H=反应物总键能-生成物总键能=436kJ·mol-1+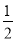 E(O2)-463 kJ·mol-1×2=-241.8kJ·mol-1,解得E(O2)=496.4 kJ·mol-1,故答案为:H2(g) +1/2O2(g)=H2O(l) ,ΔH=-285.8kJ·mol-1;496.4;
E(O2)-463 kJ·mol-1×2=-241.8kJ·mol-1,解得E(O2)=496.4 kJ·mol-1,故答案为:H2(g) +1/2O2(g)=H2O(l) ,ΔH=-285.8kJ·mol-1;496.4;
(2)碱性氢氧燃料电池的正极上氧气得到电子发生还原反应,电极反应式为O2 +2H2O +4e-=4OH-,故答案为:O2 +2H2O +4e-=4OH-;
(3)利用太阳能直接分解水制氢,是将光能转化为化学能,故答案为:将光能转化为化学能;
(4)MHx(s)+yH2(g)⇌MHx+2y(s)△H<0,该反应属于气体的物质的量发生变化的反应,a.平衡时气体的物质的量不变,容器内气体压强保持不变,正确;b.该反应为可逆反应,不能完全转化,吸收ymol H2需大于1mol MHx,错误;c.若降温,平衡正向移动,该反应的平衡常数增大,正确;d.若向容器内通入少量氢气,相当于增大压强,平衡正向移动,但温度不变,平衡常数不变,c(H2)不变,错误;故答案为:ac;
(5)①阳极发生氧化反应,铁失电子生成高铁酸根离子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
②电解过程中,阴极产生的气体为氢气,具有还原性,能够将Na2FeO4还原,因此电解过程中,须将阴极产生的气体及时排出,故答案为:防止Na2FeO4被H2还原;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故答案为:低于14mol/LNa2FeO4不稳定,高于14mol/LNa2FeO4转化为Fe(OH)3。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
