下表是元素周期表中的前四周期,回答下列问题:
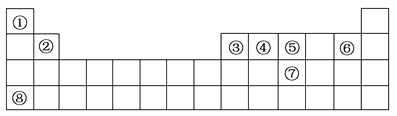
(1)按原子轨道的重叠方式,①与⑤形成的化合物中的共价键属于________(填“σ”或“π”)键。
(2)②、⑤、⑥、⑧四种元素第一电离能由高到低的顺序是________(用元素符号表示)。
(3)元素④形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
(4)元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这两种化合物分子的立体结构明显不同。③、⑥两种元素形成的化合物分子的立体结构为________,⑦的氢化物分子的立体结构为________。
【答案】σ F、N、Be、K 金刚石 分子晶体 平面三角形 三角锥形
【解析】由元素在周期表中位置,可知①为H、②为Be、③为B、④为C、⑤为N、⑥为F、⑦为P、⑧为K。(1)按原子轨道的重叠方式,①与⑤形成的化合物NH3中是氮氢单键,按原子轨道的重叠方式共价键分为σ键、π键,单键为σ键;(2)同周期自左而右,第一电离能呈增大趋势,K的4s能级容纳1个电子,容易失去,能量较高,第一电离能最低,故第一电离能:F>N>Be>K;(3)元素④为碳元素,形成的单质的晶体类型可以是原子晶体,如金刚石,也可以是分子晶体,如C60;(4)元素③、⑥形成的化合物BF3与⑦的氢化物PH3均为AB3型,但这两种化合物分子的立体结构明显不同。BF3分子的立体结构为平面三角形,PH3分子的立体结构为三角锥形。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
