工业上用NH3和CO2反应合成尿素.2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)△H1=-536.1kJ/mol(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲
问题描述:
工业上用NH3和CO2反应合成尿素.2NH3(g)+CO2(g)⇌CO(NH2)2(g)+H2O(g)△H1=-536.1kJ/mol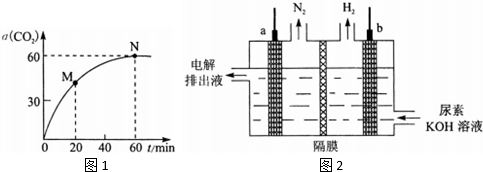 (1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲酸铵脱水生成尿素.请写出第一步的反应方程式___.(2)在一定条件下合成尿素,当氨碳比
(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,第二步是氨基甲酸铵脱水生成尿素.请写出第一步的反应方程式___.(2)在一定条件下合成尿素,当氨碳比 | n(NH3) |
| n(CO2) |
 最佳答案:
最佳答案: (1)该过程实际上分两步进行,第一步产生氨基甲酸铵,反应方程式为:2NH3(g)+CO2(g)⇌NH2COONH4,故答案为:2NH3(g)+CO2(g)⇌NH2COONH4;(2)A.从图象中可知0-60min二氧化碳的转化率始终增大,到60min后...
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
