某课外活动小组实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,类比Mg与CO2反应的思路对Mg与NO2的反应进行预测并探究Mg与NO2的反应及产物.
某课外活动小组实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,类比Mg与CO2反应的思路对Mg与NO2的反应进行预测并探究Mg与NO2的反应及产物.
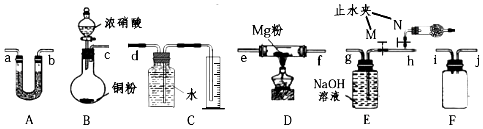
请回答下列问题:
(1)利用如图装置完成实验,连接的顺序为 (c)﹣______﹣______﹣(e)﹣(f)﹣______﹣______﹣______﹣______﹣______ .
(2)装置A中盛装的干燥剂可以是______(填序号). ①浓硫酸 ②无水CaCl2③碱石灰 ④五氧化二磷
(3)装置E的作用是______(用化学方程式表示),装置B中盛放浓硝酸的仪器名称是______ , 装置F的作用是______ .
(4)为防止空气干扰实验,排净装置中空气的具体实验操作为______ .
(5)已知装置D中初始加入的镁粉的质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温,称量,测得剩余固体的质量为21.0g,产生的气体体积为1120mL(标准状况),写出玻璃管中发生反应的化学方程式______ .
(6)在设计上若没有干燥管是否可行?请解释原因______ .
【答案】(1)a;b;i;j;h;g;d
(2)②④
(3)2NO2+2NaOH=NaNO3+NaNO2+H2O;分液漏斗;防止倒吸
(4)打开N,关闭M,滴加浓硝酸,当干燥管中充满红棕色气体时,关闭N
(5)11Mg+4NO2=Mg3N2+8MgO+N2
(6)不行,因为干燥管的作用是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气
【解析】解:(1)类比Mg与CO2 反应的思路对Mg与NO2的反应进行预测并探究Mg与NO2的反应及产物,利用装置B生成二氧化氮气体,通过装置A干燥气体,通过装置D使二氧化氮和镁粉发生反应,通过F防止倒吸,通过装置E吸收二氧化氮气体最后通过装置C测定生成气体体积,验证生成的气体为氮气,实验装置连接的顺序为 c﹣a﹣b﹣e﹣f﹣i﹣j﹣h﹣g﹣d,
所以答案是:a;b;i;j;h;g;d;(2)①浓硫酸为溶液不能用U形管干燥气体,故①错误;②无水CaCl2 为中性固体干燥剂,和二氧化氮不反应,可以干燥二氧化氮气体,故②正确;③碱石灰为氢氧化钠和氧化钙混合物,和二氧化氮发生反应,不能用来干燥二氧化氮,故③错误;④五氧化二磷为酸性干燥剂为固体,不与二氧化氮反应,可以用来干燥二氧化氮气体,故④正确;
所以答案是:②④;(3)装置E是吸收二氧化氮生成硝酸钠和亚硝酸钠,反应的化学方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,B装置B中盛放浓硝酸的仪器名称是分液漏斗,用来添加浓硝酸,装置F是安全瓶,起到防止倒吸的作用,
所以答案是:2NO2+2NaOH=NaNO3+NaNO2+H2O;分液漏斗;防止倒吸;(4)为防止空气干扰实验,排净装置中空气,利用装置E中止水夹,关闭M打开N,使装置充满红棕色气体,具体实验操作为打开N,关闭M,滴加浓硝酸,当干燥管中充满红棕色气体时,关闭N
所以答案是:打开N,关闭M,滴加浓硝酸,当干燥管中充满红棕色气体时,关闭N;(5)已知装置E中初始加入Mg粉质量为13.2g,物质的量= 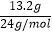 =0.55mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g为氮化镁和氧化镁,产生N2的体积为1120mL(标准状况)物质的量=
=0.55mol,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g为氮化镁和氧化镁,产生N2的体积为1120mL(标准状况)物质的量= 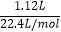 =0.05mol.
=0.05mol.
设生成Mg3N2的物质的量为xmol,MgO的物质的量为Ymol,可得到3x+y=0.55mol,100x+40y=21.0g
解得x=0.05,y=0.4,N2的物质的量为0.05mol,
n(Mg):n(Mg3N2):n(MgO):n(N2)=0.55:0.05:0.4:0.05=11:1:8:1:,结合氮原子守恒NO2前系数为4,
即得到11Mg+4NO2=Mg3N2+8MgO+N2 ,
所以答案是:11Mg+4NO2=Mg3N2+8MgO+N2;(6)在设计上若没有干燥管,在充满二氧化氮气体过程中二氧化氮会排放到空气中污染环境,若没有干燥管不行,因为干燥管的作用是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气,
所以答案是:不行,因为干燥管的作用是在充满二氧化氮气体过程中避免污染气体排放到空气中污染空气.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
