污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
I.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:1、4:1时,NO脱除率随温度变化的曲线如图所示。
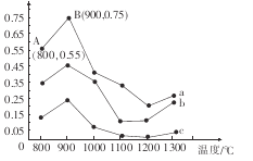
①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为___________________mg/(m3.s)。
②曲线b对应的NH3与NO的物质的量之比是_______,其理由是___________________。
(2)已知在25℃,101 kPa时:
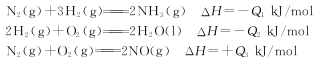
请写出用NH3脱除NO的热化学方程式:_______________________________。
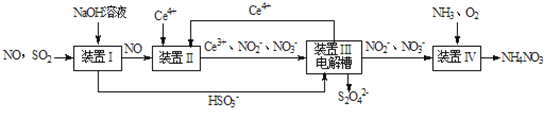
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:
含硫各微粒(H2SO3、HSO3-和SO32-)存在于装置I反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。
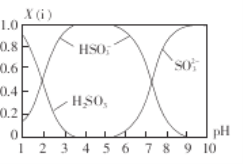
①溶液的pH=8时,溶液中各离子浓度由大到小的顺序是_________________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:___________________________。
(4)装置Ⅱ中NO转变为NO3-的反应的离子方程式为______________________。
【答案】 1.5×10-4 3:1 NH3 与NO的物质的量比值越大,NO的脱除率越大 4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH=-(3Q2+3Q3-2Q1)kJ/mol c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+) HSO3-在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后, Ca2++SO32- ===CaSO3↓,使电离平衡向右移,c(H+)增大 3Ce4++NO+2H2O===3Ce3++NO3-+4H+
SO32-+H+,加入CaCl2溶液后, Ca2++SO32- ===CaSO3↓,使电离平衡向右移,c(H+)增大 3Ce4++NO+2H2O===3Ce3++NO3-+4H+
I.①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的浓度变化为6×10-4mg/m3×(0.75-0.55)=1.2×10-4mg/m3,根据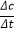 计算脱除速率;②氨气的浓度越大,NO脱除率越高;(2)根据盖斯定律
计算脱除速率;②氨气的浓度越大,NO脱除率越高;(2)根据盖斯定律
计算用NH3脱除NO的焓变;
Ⅱ.(1)①溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远大于c(OH-)。
②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-= CaSO3↓使电离平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-= CaSO3↓使电离平衡右移,c(H+)增大。
(3)在酸性条件下装置Ⅱ中,Ce4+将NO氧化为NO3-或NO2-,本身还原为Ce3+,
解析: I.①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的浓度变化为6×10-4mg/m3×(0.75-0.55)=1.2×10-4mg/m3,根据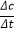 ,NO的脱除速率
,NO的脱除速率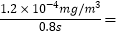 1.5×10-4 mg/(m3.s) ;
1.5×10-4 mg/(m3.s) ;
②NH3 与NO的物质的量比值越大,NO的脱除率越大,所以b对应的NH3与NO的物质的量之比是3:1;
(2)①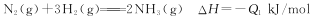
②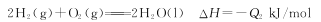
③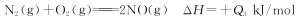
根据盖斯定律②×3+③×3-①×2得4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH=-(3Q2+3Q3-2Q1)kJ/mol;
Ⅱ.(1)①溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远大于c(OH-),所以溶液中离子浓度为:c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。
②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-= CaSO3↓使电离平衡右移,c(H+)增大。
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-= CaSO3↓使电离平衡右移,c(H+)增大。
(3)在酸性条件下装置Ⅱ中,Ce4+将NO氧化为NO3-或NO2-,本身还原为Ce3+,反应离子方程式为3Ce4++NO+2H2O===3Ce3++NO3-+4H+;
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
