为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: <img alt="1" src="/tk
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: 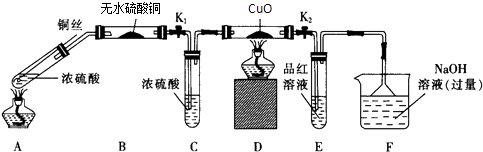
(1)F装置的烧杯中发生反应的离子方程式是______;B装置中的现象是______ .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是______
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______ 实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S.产生Cu2S的反应为aCu+bH2SO4 cCu2S+dCuSO4+e H2O,则a:b=______ .
cCu2S+dCuSO4+e H2O,则a:b=______ .
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,以淀粉溶液为指示剂,用O.36mol•L﹣1的Na2S2O3溶液滴定生成的I2 , 3次实验平均消耗该Na2S2O3溶液25.00mL.若反应消耗铜的质量为6.4g,则硫酸铜的产率为______ . (已知2Cu2++4I﹣=2CuI+I2 , 2S2O32﹣+I2=S4O62﹣+2I﹣)
【答案】(1)SO2+2OH﹣=SO32﹣+H2O;白色粉末变蓝色
(2)D装置中黑色固体颜色无变化,E装置中溶液褪色
(3)拉起铜丝,关闭K1 , K2
(4)将A装置中冷却的混合溶液沿烧杯内壁缓缓倒入盛水的烧杯中,并不断搅拌,观察是否有蓝色出现
(5)5:4
(6)90%
【解析】2Cu2+~I2~
2S2O32﹣ ,
2mol
2mol
0.025xmol
(0.36×0.025)mol
2molL:2mol=0.025xmol:(0.36×0.025)molx= 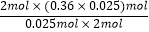 =0.36,则250mL溶液中n(Cu2+)=0.36mol/L×0.25L=0.09mol,参加反应的n(Cu)=
=0.36,则250mL溶液中n(Cu2+)=0.36mol/L×0.25L=0.09mol,参加反应的n(Cu)=  =0.1mol,则硫酸铜的产率=
=0.1mol,则硫酸铜的产率=  =90%,所以答案是:90%.
=90%,所以答案是:90%.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
