已知X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大.X与V同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y与U同主族且Y原子的L层电子数是K层电子数的2倍
已知X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大.X与V同主族,且与W都能形成A2B、A2B2型化合物;Z、W的单质常温下均为无色气体;Y与U同主族且Y原子的L层电子数是K层电子数的2倍.试回答下列问题:
(1)写出U元素在周期表中的位置______;V离子结构示意图为______;YW2的电子式______ .
(2)Y、U的简单氢化物的稳定性由弱到强的顺序是______ .
(3)V的最高价氧化物的水化物不能使用玻璃塞试剂瓶盛放的原因是______ . (用化学方程式表示)
(4)由X、Z组成的一种化合物化学式为ZX5 , 其各原子均达到同周期稀有气体原子的稳定结构,该物质属于______(填“离子”或“共价”)化合物.
(5)X、Y、Z、W四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:______ .
【答案】(1)第3周期第IVA族;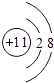 ;
;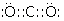
(2)SiH4<CH4
(3)SiO2+2NaOH=Na2SiO3+H2O
(4)离子
(5)NH4++HCO3﹣+2OH﹣ NH3↑+CO32﹣+2H2O
NH3↑+CO32﹣+2H2O
解:X、Y、Z、W、V、U是短周期的主族元素,原子序数依次增大.Y原子的L层电子数是K层电子数的2倍,则其L层电子数为4,故Y为C元素;Y与U同主族,则U为Si;Z、W的单质常温下均为无色气体,二者原子序数均低于碳,故Z为N元素、W为O同时;X与V同主族,且与W(氧)都能形成A2B、A2B2型化合物,则X为H元素、V为Na.
(1.)U为Si,元素在周期表中的位置:第3周期第IVA族,Na+离子结构示意图为 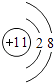 ,CO2的电子式为
,CO2的电子式为 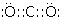 ,所以答案是:第3周期第IVA族;
,所以答案是:第3周期第IVA族; 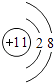 ;
; 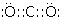 ;
;
(2.)Y、U的简单氢化物分别为CH4、SiH4 , 非金属性Si<C,故稳定性由弱到强的顺序是SiH4<CH4 ,
所以答案是:SiH4<CH4;
(3.)V的最高价氧化物的水化物为NaOH,不能使用玻璃塞试剂瓶盛放的原因是:SiO2+2NaOH=Na2SiO3+H2O,所以答案是:SiO2+2NaOH=Na2SiO3+H2O;
(4.)由H、N组成的一种化合物化学式为NH5 , 其各原子均达到同周期稀有气体原子的稳定结构,该化合物为NH4H,由铵根离子与氢负离子构成,属于离子化合物,
所以答案是:离子;
(5.)H、C、N、O四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物为NH4HCO3 , 该化合物的稀溶液与足量氢氧化钠溶液在加热条件下反应的离子方程式为:NH4++HCO3﹣+2OH﹣ NH3↑+CO32﹣+2H2O,
NH3↑+CO32﹣+2H2O,
所以答案是:NH4++HCO3﹣+2OH﹣ NH3↑+CO32﹣+2H2O.
NH3↑+CO32﹣+2H2O.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
