150℃时,向下图所示的恒压容器中加入4LN2和 H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),正反应放热。反应后恢复到原温度。平衡后容器体轵变为3.4L,容器内气体对相同条件的氢气的
150℃时,向下图所示的恒压容器中加入4LN2和 H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),正反应放热。反应后恢复到原温度。平衡后容器体轵变为3.4L,容器内气体对相同条件的氢气的相对密度为5。
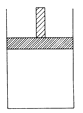
(1)反应前混合气体中V(N2):V(H2)=______;反应达平衡后V(NH3)=__L;该反应中N2转化率为___。
(2)向平衡后的容器中充入0.2mol的NH3,一段时间后反应再次达到平衡,恢复到150℃时测得此过程中从外界吸收了6.44 kJ的热量。请回答:充入NH3时,混合气体的密度将__________(填“增大”、“减小”或“不变”),在达到平衡的过程中,混合气体的密度将____(填“增大”、“减小”或“不变”)。反应重新达平衡昀混合气体对氢气的相对密度将______5(填“>”、“<”或 “ = ”)
【答案】1:3 0.6 30% 增大 减小 =
【解析】本题考查化学平衡的计算,恒温恒压下的等效平衡、影响化学平衡的因素以及各物理量的变化。
(1)设原N2的体积为x,则原H2的体积为4-x,转化的N2体积为y,在恒温恒压下气体体积之比等于物质的量之比,运用三段式
N2 + 3H2 2NH3
2NH3
V(起始)(L) x 4-x 0
V(转化)(L) y 3y 2y
V(平衡)(L) x-y 4-x-3y 2y
则(x-y)+(4-x-3y)+2y=3.4L,y=0.3L。平衡后容器内气体对相同条件的氢气的相对密度为5,平衡后混合气体的平均相对分子质量为5 2=10,根据质量守恒得28x+2(4-x)=10
2=10,根据质量守恒得28x+2(4-x)=10 3.4,x=1L。反应前混合气体中V(N2):V(H2)=1L:(4L-1L)=1:3。反应达平衡后V(NH3)=2
3.4,x=1L。反应前混合气体中V(N2):V(H2)=1L:(4L-1L)=1:3。反应达平衡后V(NH3)=2 0.3L=0.6L。N2的转化率为0.3L
0.3L=0.6L。N2的转化率为0.3L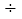 1L
1L 100%=30%。
100%=30%。
(2)由于该容器为恒温恒压容器,混合气体的密度与平均摩尔质量成正比,平衡后再充入0.2mol的NH3,由于NH3的摩尔质量(17g/mol)大于平衡时平均摩尔质量(10g/mol),充入NH3时混合气体的密度将增大。将0.2molNH3采用极限一边倒换算后为0.1molN2和0.3molH2,与原平衡的起始对应物质成比例,则达到的新平衡与原平衡为恒温恒压下的等效平衡,即重新达到平衡时混合气体的平均摩尔质量仍为10g/mol,所以在达到平衡的过程中,混合气体的密度将减小,重新达到平衡时混合气体对氢气的相对密度不变,仍等于5。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
