A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为空气的成分。F的焰色反应是黄色。在G中,金属元素与非金属元素的原子个数比为2:1。在一定条件下,各物质之间的相互转化关系如图(
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为空气的成分。F的焰色反应是黄色。在G中,金属元素与非金属元素的原子个数比为2:1。在一定条件下,各物质之间的相互转化关系如图(反应条件及部分产物未列出):
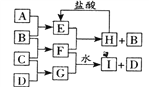
(1)A的元素符号是______________,F的电子式为________________________。
(2)E与F反应的化学方程式:_________________________________________。
(3)F与G的水溶液反应的离子方程式:______________________________。
(4)硫与热浓氢氧化钠溶液反应的离子方程式:__________________________。
(5)在加热条件下浓硝酸可把硫单质氧化到最高价产物,写出反应的化学方程式:___________。
【答案】 C  2Na2O2+2CO2=2Na2CO3+O2 Na2O2+S2-+2H2O=S↓+2Na++4OH- 3S+6OH-
2Na2O2+2CO2=2Na2CO3+O2 Na2O2+S2-+2H2O=S↓+2Na++4OH- 3S+6OH- 2S2-+SO32-+3H2O 6HNO3(浓)+S
2S2-+SO32-+3H2O 6HNO3(浓)+S H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
F的焰色反应呈黄色,说明F是钠的化合物,而F是单质B、C化合而成,B、E均为组成空气的成分,故C为金属钠;G是单质C、D化合而成,原子个数比为D:C=1:2,且原子序数D>C,故D为硫,G为Na2S;B为组成空气的成分,最容易想到的是O2,如B为O2,E也为组成空气的成分,E只能是CO2,A即为碳,因F+E=H+B,故F是Na2O2,H是Na2CO3。
(1)由以上分析可知A为C,F是Na2O2,由钠离子与过氧根离子构成,电子式为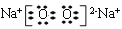 ,故答案为:C;
,故答案为:C; ;
;
(2)E与F反应为CO2和Na2O2的反应,生成碳酸钠和氧气,反应的化学方程式为2CO2+2Na2O2═2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)Na2O2与过量的Na2S溶液反应的离子方程式是:Na2O2+S2-+2H2O═2Na++S↓+4OH-,故答案为:Na2O2+S2-+2H2O═2Na++S↓+4OH-;
(4)硫与热浓氢氧化钠溶液反应生成硫化钠、亚硫酸钠和水,反应的离子方程式为3S+6OH- 2S2-+SO32-+3H2O,故答案为:3S+6OH-
2S2-+SO32-+3H2O,故答案为:3S+6OH- 2S2-+SO32-+3H2O;
2S2-+SO32-+3H2O;
(5)在加热条件下浓硝酸可把硫单质氧化生成硫酸,反应的化学方程式为6HNO3(浓)+S H2SO4+6NO2↑+2H2O,故答案为:6HNO3(浓)+S
H2SO4+6NO2↑+2H2O,故答案为:6HNO3(浓)+S H2SO4+6NO2↑+2H2O。
H2SO4+6NO2↑+2H2O。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
