已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)常温下Y的单质能与水发生反应,则X位于周期表_________,X、Y形成简单离子半径大小关系为X_____________Y(填“大于”、“小于”或“等于”)。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
①则甲为___________(填化学式)。该气体能使高锰酸钾溶液褪色,该反应的离子方程式为_______________。
②25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液X2+离子沉淀完全,则加入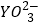 离子的最小浓度为___________mol•L﹣1。
离子的最小浓度为___________mol•L﹣1。

(3)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙中所含化学键类型____________。
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为________________。
【答案】 第四周期、第IA族 小于 4KClO3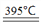 3KClO4 + KCl CaSO3 2MnO4-+5SO2+ 2H2O =2Mn2++5SO42-+ 4H+ 2.1×10-2 极性键或共价键 MgCO3 + H2O
3KClO4 + KCl CaSO3 2MnO4-+5SO2+ 2H2O =2Mn2++5SO42-+ 4H+ 2.1×10-2 极性键或共价键 MgCO3 + H2O Mg(OH)2 + CO2↑
Mg(OH)2 + CO2↑
本题考查元素的推断,微粒半径大小的比较,化学键的判断,方程式的书写,沉淀溶解平衡的计算。
(1)Y的单质能与水发生反应,Y为Cl元素;含氧酸盐甲的化学式为XClO3,X位于Y的下一周期,X、Y的原子序数均不大于20,X为K元素;K为19号元素,K位于周期表中第四周期第IA族。X的简单离子为K+,Y的简单离子为Cl-,K+与Cl-具有相同的电子层结构,根据“序大径小”,离子半径K+小于Cl-。395℃时KClO3分解生成的无氧酸盐为KCl,Cl元素的化合价由+5价降至-1价,根据氧化还原反应规律,则生成的另一种盐为KClO4,反应的化学方程式为4KClO3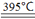 3KClO4+KCl。
3KClO4+KCl。
(2)若甲难溶于水,甲与盐酸反应生成能使品红溶液褪色的气体,该气体为SO2,则Y为S元素;含氧酸盐甲的化学式为XSO3,X位于Y的下一周期,X的原子序数不大于20,X为Ca元素。
①甲的化学式为CaSO3。CaSO3与盐酸反应生成的气体为SO2,SO2与KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
②CaSO3在溶液中存在的溶解平衡为:CaSO3(s) Ca2+(aq)+SO32-(aq),根据图像Ksp(CaSO3)=c(Ca2+)·c(SO32-)=0.3
Ca2+(aq)+SO32-(aq),根据图像Ksp(CaSO3)=c(Ca2+)·c(SO32-)=0.3 10-3
10-3 0.7
0.7 10-3=2.1
10-3=2.1 10-7;使Ca2+沉淀完全,c(Ca2+)
10-7;使Ca2+沉淀完全,c(Ca2+) 1
1 10-5mol/L,c(SO32-)
10-5mol/L,c(SO32-) K sp(CaSO3)
K sp(CaSO3)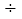 c(Ca2+)=2.1
c(Ca2+)=2.1 10-7
10-7 (1
(1 10-5)=2.1
10-5)=2.1 10-2(mol/L),加入SO32-的最小浓度为2.1
10-2(mol/L),加入SO32-的最小浓度为2.1 10-2mol/L。
10-2mol/L。
(3)若甲能与盐酸反应生成无色、无味的气体乙,则Y为C元素,乙为CO2;含氧酸盐甲的化学式为XYO3,X位于Y的下一周期,X为Mg元素;甲为MgCO3。
①乙为CO2,CO2的电子式为 ,CO2中含有极性共价键。
,CO2中含有极性共价键。
②MgCO3在水中持续加热生成CO2,同时生成的更难溶的物质是Mg(OH)2,该反应的化学方程式为MgCO3+H2O Mg(OH)2+CO2↑。
Mg(OH)2+CO2↑。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
