从能量的角度看,断开化学键要______ , 形成化学键要______ . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.
从能量的角度看,断开化学键要______ , 形成化学键要______ . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要______(填“放出”或“吸收”)________k J的热量.当反应物的总能量高于生成物总能量时,该反应为______反应;当反应物的总能量低于生成物总能量时,该反应为______反应.
【答案】吸收能量;放出能量;放出;5.5;吸热;放热
【解析】化学反应的实质是旧键的断裂和新键的形成,从能量的角度看,断开化学键要吸收能量,形成化学键要释放能量;
氢气与碘反应的化学方程式:H2+I2=2HI
依据△H=反应物总键能﹣生成物总键能,生成2molHI,△H=436KJ+151KJ﹣299KJ×2=﹣11KJ/mol,则生成1molHI放出的热量为: 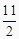 KJ=5.5KJ;
KJ=5.5KJ;
依据能量守恒定律:当反应物的总能量高于生成物总能量时,反应放热;当反应物的总能量低于生成物总能量时,反应吸热;
所以答案是:吸收热量;放出能量;放出; 5.5;吸热; 放热.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
