对于可逆反应N2+3H2 <img alt="1" src="/tk/20210512/1620758113301.png"/>2NH3(反应条件略
对于可逆反应N2+3H2  2NH3(反应条件略去),回答下列问题:
2NH3(反应条件略去),回答下列问题:
(1)在恒温恒容条件下,下列表述中,不能说明该反应达到平衡状态的有( )
A.体系的压强保持不变
B.某时刻H2和NH3的浓度之比是3:2
C.相同时间内,断裂6NA个N-H键,同时断裂3NA个H-H键
D.某时刻反应速率满足:3v(N2)=v(H2)
E.混合气体的平均摩尔质量不变
(2)下列措施能加快反应速率的有( )
A.降温
B.将NH3分离出体系
C.恒温恒容条件下,加入N2
D.恒温恒压条件下,加入He
(3)若测得达到平衡时,氮气和氢气的转化率相等,则氮气和氢气的起始投料物质的量之比为__________
 (4)若断裂1molN≡N需要吸热akJ,断裂1molH-H需要吸热bkJ,形成1molN-H放热ckJ,如果nmolN2参加反应(假设N2完全转化),则该过程放热______________kJ
(4)若断裂1molN≡N需要吸热akJ,断裂1molH-H需要吸热bkJ,形成1molN-H放热ckJ,如果nmolN2参加反应(假设N2完全转化),则该过程放热______________kJ
(5)在恒温恒压的密闭容器中,加入一定量的氮气和氢气进行反应,若达到平衡时,混合气体的密度是反应前的1.2倍,则达到平衡时,混合气体中氨气的体积分数为_________
【答案】(1)BD;(2)C;(3)1:3;(4)n(6c-a-3b);(5)20%(或1/5)
【解析】(1)A.该反应属于气体的物质的量发生变化的反应,体系的压强保持不变,能够说明该反应达到平衡状态,不选;B.某时刻H2和NH3的浓度之比是3:2,正逆反应速率不一定相等,不能说明该反应达到平衡状态,选;C.相同时间内,断裂6NA个N-H键,同时一定形成3NA个H-H键,同时断裂3NA个H-H键,能够说明该反应达到平衡状态,不选;D.任何时刻反应速率都满足:3v(N2)=v(H2),不能说明该反应达到平衡状态,选;E.混合气体的质量不变,物质的量发生变化,只有平衡时混合气体的平均摩尔质量不变,能够说明该反应达到平衡状态,不选;故选BD;
(2)A.降温,反应速率减慢,错误;B.将NH3分离出体系,浓度减小,反应速率减慢,错误;C.恒温恒容条件下,加入N2,浓度增大,反应速率加快,正确;D.恒温恒压条件下,加入He,浓度减小,反应速率减慢,错误;故选C。
(3)氮气和氢气的起始投料物质的量分别为x、y,根据氮气和氢气的转化率相等,设为a,则x×a:y×a=1:3,解得,x:y=1:3,故答案为:1:3;
 (4)反应放出的热量=生成物的键能之和-反应物的键能之和=6cn-(an+3bn)=n(6c-a-3b)kJ,故答案为:n(6c-a-3b);
(4)反应放出的热量=生成物的键能之和-反应物的键能之和=6cn-(an+3bn)=n(6c-a-3b)kJ,故答案为:n(6c-a-3b);
(5)假设原混合物的总体积为100,设原混合气体中氮气的体积为a,则氢气的体积为(100-a),令参加反应的氮气为x,则:
N2 +3H2  2NH3
2NH3
起始(L):a 100-a 0
转化(L):x 3x 2x
平衡(L):a-x100-a-3x 2x
混合气体总质量不变,则密度与体积成反比,则有: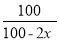 =1.2,解得x=
=1.2,解得x=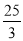 ,
,
混合气体体积减少量等于氨气的体积,所以氨气的体积分数为[(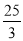 ×2)/(100-
×2)/(100-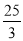 ×2)]×100%=20%,故答案为:20%。
×2)]×100%=20%,故答案为:20%。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
