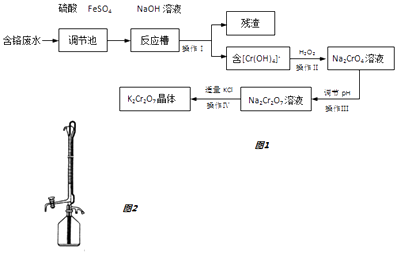
某兴趣小组模拟企业对含铬废水(Cr2O72﹣和Cr3+)处理流程如图1
已知:2CrO42﹣+2H+═Cr2O72﹣+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应:______ .
(2)操作Ⅰ得到的残渣的化学式为______ .
(3)操作Ⅲ调节pH时最适合作为调节剂的是____________ .
A.4mol•L﹣1盐酸
B.6mol•L﹣1硫酸
C.石灰乳
D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72﹣完全转化为Cr3+ , 再用amol•L﹣1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72﹣→2Cr3+ , Cr3++Y4﹣=CrY﹣
①滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是______ .
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为______mg•L﹣1(用含a、b的式子表示).
【答案】(1)Cr2O72﹣+14H++6Fe2+=2Cr3++6Fe3++7H2O
(2)Fe(OH)3
(3)B
(4)操作简单,无视力误差,计算精确;520ab
【解析】解:含铬废水(Cr2O72﹣和Cr3+)加入硫酸和硫酸亚铁,进入调节池发生氧化还原反应收藏铁离子和铬离子,加入氢氧化钠溶液过滤得到滤渣为氢氧化铁沉淀,滤液含Cr(OH)4﹣ , 加入过氧化氢酸性溶液中氧化Cr(OH)4﹣ , 生成Na2CrO4 , 操作Ⅲ小调节溶液PH,2CrO42﹣+2H+═Cr2O72﹣+H2O,酸溶液应选择硫酸,盐酸易被氧化所以不选择盐酸,得到的Na2Cr2O7溶液,加入适量KCl过滤得到K2Cr2O7晶体,(1)调节池里发生的反应是酸性溶液中重铬酸跟离子氧化亚铁离子生成铁离子的反应,反应的离子方程式为:Cr2O72﹣+14H++6Fe2+=2Cr3++6Fe3++7H2O,所以答案是:Cr2O72﹣+14H++6Fe2+=2Cr3++6Fe3++7H2O;(2)分析可知,操作Ⅰ得到的残渣为氢氧化铁,化学式为:Fe(OH)3 , 所以答案是:Fe(OH)3;(3)操作Ⅲ调节pH时最适合作为调节剂的是非还原性的酸,
A.4mol•L﹣1盐酸也会被重铬酸根离子氧化生成氯气,故A错误;
B.6mol•L﹣1硫酸溶液可以调节溶液PH,起到酸化作用,故B正确;
C.石灰乳为氢氧化钙浊液,不能调节溶液PH得到Cr2O72﹣离子,故C错误;
D.碳酸钠溶液显碱性,2CrO42﹣+2H+═Cr2O72﹣+H2O,平衡逆向进行不能得到Cr2O72﹣离子,故D错误;
所以答案是:B;(4)①自动定零位滴定管使得测定结果更准确,操作简单,滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是:操作简单,无视力误差,计算精确,
所以答案是:操作简单,无视力误差,计算精确;
②Cr2O72﹣→2Cr3+ , Cr3++Y4﹣=CrY﹣
反应定量关系为:Cr2O72﹣→2Cr3+~2H4Y(EDTA)
n(Cr3+)=n(EDTA)=amol•L﹣1×b×10﹣3L=ab×10﹣3mol,
计算得到铬离子的浓度= 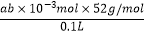 =0.52abg/L=520ab mg/L.
=0.52abg/L=520ab mg/L.
所以答案是:520ab mg/L;
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
