某校兴趣小组拟用如图1装置制取Cl2(气密性已检验,试剂已添加),并研究其相关性质. <img alt="1" src="/tk/20210511/16207482
某校兴趣小组拟用如图1装置制取Cl2(气密性已检验,试剂已添加),并研究其相关性质. 
(1)写出烧瓶内反应的化学方程式______
(2)欲证明干燥的Cl2无漂白性而HClO有漂白性,实验方案为:______ .
(3)将生成的氯气通过图2装置: ①观察到图2丙中的现象是______ . 能证明发生此变化是由HClO的漂白性引致的实验是______ .
②取20mL图2乙中的溶液加入锥形瓶中,加入足量的KI溶液,以淀粉液为指示剂,用浓度为0.01000mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液的体积为25.00mL.则饱和食盐水中Cl2的含量为______g/L(忽略其中的HClO,结果保留4位有效数字)
【答案】(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)将生产的气体先后通过装有浓硫酸、干燥红纸、湿润红纸的洗气瓶中,干燥红纸不褪色而湿润的红纸褪色
(3)溶液由红色变无色;取已完全褪色的丙中溶液少量于试管中,滴加过量的NaOH溶液,如溶液不变色,证明原褪色是由HClO的漂白性引致;0.4438
【解析】解:(1)烧瓶内反应为二氧化锰和浓盐酸制备氯气,化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O; 所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; 所以答案是:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O;(2)证明干燥的Cl2无漂白性而HClO有漂白性,可将干燥的氯气分别通入干燥的有色纸条与湿润的有色纸条对比,方法为:将生产的气体先后通过装有浓硫酸、干燥红纸、湿润红纸的洗气瓶中,干燥红纸不褪色而湿润的红纸褪色;
MnCl2+Cl2↑+2H2O;(2)证明干燥的Cl2无漂白性而HClO有漂白性,可将干燥的氯气分别通入干燥的有色纸条与湿润的有色纸条对比,方法为:将生产的气体先后通过装有浓硫酸、干燥红纸、湿润红纸的洗气瓶中,干燥红纸不褪色而湿润的红纸褪色;
所以答案是:将生产的气体先后通过装有浓硫酸、干燥红纸、湿润红纸的洗气瓶中,干燥红纸不褪色而湿润的红纸褪色;(3)①将氯气通入滴有酚酞的氢氧化钠溶液,次氯酸将其漂白为无色,要证明发生此变化是由HClO的漂白性引致的,可是溶液显碱性观察溶液颜色,不恢复,说明不是碱性减弱所致,而是次氯酸的漂白性所致,方法为:取已完全褪色的丙中溶液少量于试管中,滴加过量的NaOH溶液,如溶液不变色,证明原褪色是由HClO的漂白性引致;
所以答案是:溶液由红色变无色;取已完全褪色的丙中溶液少量于试管中,滴加过量的NaOH溶液,如溶液不变色,证明原褪色是由HClO的漂白性引致;②取20mL图2乙中的溶液加入锥形瓶中,加入足量的KI溶液,Cl2+2I﹣=I2+Cl﹣ , 以淀粉液为指示剂,用浓度为0.01000mol/L的Na2S2O3溶液滴定,I2+2S2O32﹣═2I﹣+S4O62﹣ , 消耗Na2S2O3溶液的体积为25.00mL,则Cl2~2S2O32﹣ , m(Cl2)=  n(Na2S2O3),饱和食盐水中Cl2的含量为
n(Na2S2O3),饱和食盐水中Cl2的含量为 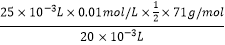 =0.4438g/L;
=0.4438g/L;
所以答案是:0.4438.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
