难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)<img alt="1"
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO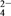 (aq)+2H2O
(aq)+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
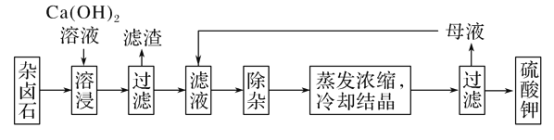
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入 ________溶液调滤液pH至中性。
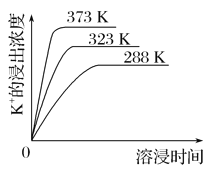
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,①___,
②_________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO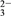 (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO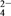 (aq)
(aq)
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。_________
【答案】 Mg(OH)2 CaSO4(二者位置互换也正确) 加入Ca(OH)2溶液后,生成Mg(OH)2、CaSO4沉淀,溶液中Mg2+浓度减小,使平衡右移 K2CO3 H2SO4 溶浸达到平衡的时间缩短 平衡时K+的浸出浓度增大(其他合理答案也可) CaSO4(s) Ca2+(aq)+SO
Ca2+(aq)+SO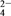 (aq) Ksp(CaSO4)=c(Ca2+)·c(SO
(aq) Ksp(CaSO4)=c(Ca2+)·c(SO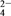 ) CaCO3(s)
) CaCO3(s) Ca2+(aq)+CO
Ca2+(aq)+CO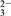 (aq) Ksp(CaCO3)=c(Ca2+)·c(CO
(aq) Ksp(CaCO3)=c(Ca2+)·c(CO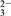 ) K=
) K=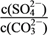 =
=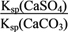 =
=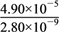 =1.75×104
=1.75×104
杂卤石在水中存在如下溶解平衡:K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2 Ca2++2K++Mg2++4 SO42-+2H2O,向杂卤石中加入Ca(OH)2溶液,氢氧根离子和镁离子反应生成更难溶的Mg(OH)2沉淀,钙离子和硫酸根离子浓度达到一定程度时生成CaSO4沉淀,所以得到的滤渣成分是Mg(OH)2、CaSO4和未溶解的杂卤石,滤液中含有Ca2+、K+、OH-、SO42-,向滤液中加入过量K2CO3,除去溶液中的Ca2+,然后再加入稀硫酸除去过量的CO32-,调节溶液的pH得到较纯净的硫酸钾,然后将溶液蒸发浓缩得到硫酸钾晶体。
(1)通过以上分析知,滤渣成分是Mg(OH)2、CaSO4和未溶解的杂卤石,故答案为:CaSO4;Mg(OH)2;
(2)加入Ca(OH)2溶液,Ca(OH)2电离生成的氢氧根离子和镁离子反应生成Mg(OH)2沉淀,从而减小镁离子浓度,导致固体溶解,所以K+增多,故答案为:加入Ca(OH)2溶液后,生成Mg(OH)2、CaSO4沉淀,溶液中Mg2+浓度减小,使平衡右移;
(3)除杂环节中,要加入过量的K2CO3除去钙离子、加入稀硫酸除去过量的K2CO3,故答案为:K2CO3;H2SO4;
(4)不同温度下,温度越高K+的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:温度越高,在同一时间K+的浸出浓度大;反应速率加快,平衡时溶浸时间短,故答案为:①在同一时间K+的浸出浓度大;②反应的速率加快,平衡时溶浸时间缩短;
(5)溶浸过程中会发生:CaSO4(s)+CO32-(aq)⇌CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-;CaSO4(s)=Ca2++SO42-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=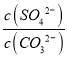 =
=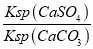 =
=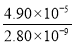 =1.75×104,故答案为:1.75×104。
=1.75×104,故答案为:1.75×104。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
