为了探究实验富制氯气过程中反应物与生成氯气之间量的关系.设计了如图所示的装置
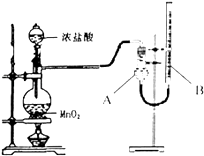
(1)装置A的名称是______
(2)该实验装置检查气密性的方法是______
(3)如果将过二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有______
a.加热使浓盐酸放出大量HCl
b.盐酸变稀后不发生该反应
c.烧瓶中残留有氯气
d.装置B中液面高于A.
【答案】(1)干燥管
(2)关闭分液漏斗活塞,向B中加入水至液面高于A,若液面差保持不变则装置气密性良好
(3)abd
【解析】解:(1)由装置图可知装置A为干燥管,所以答案是:干燥管;(2)可利用压强差原理检查气密性,操作方法为关闭分液漏斗活塞,向B中加入水至液面高于A,若液面差保持不变则装置气密性良好,所以答案是:关闭分液漏斗活塞,向B中加入水至液面高于A,若液面差保持不变则装置气密性良好;(3)n(HCl)=0.24mol,反应的方程式为MnO2+4HCl  MnCl2+Cl2↑+2H2O,如盐酸完全反应,则生成0.06mol氯气,盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,测量气体体积时,A、B液面应相等,如装置B中液面高于A,A中压强较大,气体体积较小,氯气将空气排除,则装置内一定残留氯气,不是导致体积偏小的原因,
MnCl2+Cl2↑+2H2O,如盐酸完全反应,则生成0.06mol氯气,盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应,测量气体体积时,A、B液面应相等,如装置B中液面高于A,A中压强较大,气体体积较小,氯气将空气排除,则装置内一定残留氯气,不是导致体积偏小的原因,
所以答案是:abd.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
下一篇 :返回列表
