现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL﹣1).<br/>(1)实验步骤 <br/>①用______(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL﹣1).(1)实验步骤 ①用______(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL______(填仪器名称)中定容,摇匀即得待测白醋溶液.②用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴______作指示剂.③读取盛装0.100 0mol•L﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______mL. ④滴定.当______时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.(2)实验记录
④滴定.当______时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.(2)实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
数据处理与讨论①按实验所得数据,可得c(市售白醋)=______mol•L﹣1(列式计算);市售白醋总酸量=______g•100mL﹣1(列式计算).②在本实验的滴定过程中,下列操作会使实验结果偏大的是______填写序号).a.碱式滴定管在滴定时未用标准NaOH溶液润洗b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失c.锥形瓶中加入待测白醋溶液后,再加少量水d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
【答案】(1)酸式滴定管;容量瓶;酚酞;0.60;溶液由无色恰好变为红色,并在半分钟内不褪色
(2)0.75;4.5;ab
【解析】CH3COOOH
~
NaOH
60
40
xg×0.2
0.1000mol/L×0.015L×40g/mol
x=0.450c(市售白醋)=  =0.75mol•L﹣1 , 样品总酸量
=0.75mol•L﹣1 , 样品总酸量 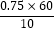 =4.50g•100mL﹣1;所以答案是:0.75;4.5;②a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)=
=4.50g•100mL﹣1;所以答案是:0.75;4.5;②a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)= 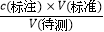 分析,可知c(待测)偏大,故a正确; b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
分析,可知c(待测)偏大,故a正确; b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= 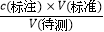 分析,可知c(待测)偏大,故b正确; c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)=
分析,可知c(待测)偏大,故b正确; c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)= 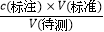 分析,可知c(待测)不变,故c错误; d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析,可知c(待测)不变,故c错误; d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)= 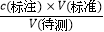 分析,可知c(待测)偏小,故d错误;故选:ab.【考点精析】认真审题,首先需要了解酸碱中和滴定(中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点).
分析,可知c(待测)偏小,故d错误;故选:ab.【考点精析】认真审题,首先需要了解酸碱中和滴定(中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点).
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
