硫化物按其溶解性可以分三类:①易溶于水的有K2S,Na2S,(NH4)2S等;②易溶于非氧化性强酸,不溶于水的有FeS,ZnS等;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS,Ag2S,C
硫化物按其溶解性可以分三类:①易溶于水的有K2S,Na2S,(NH4)2S等;②易溶于非氧化性强酸,不溶于水的有FeS,ZnS等;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS,Ag2S,CuS,Cu2S等。其中,Ag2S,CuS,Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水。
(1)推测硫化氢通入硫酸铜溶液中能否发生反应?若能,写出反应的离子方程式;若不能,写出原因_________________。
(2)在氢硫酸溶液中改变下列条件,能使溶液中c(OH-)、c(S2-)都增大的是_____。
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(3)已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)达到1mol·L-1,应调节溶液的pH为____________(已知lg2=0.3)。
(4)将Hg加入到一定浓度的H2S溶液中,有氢气产生,原因为_____________。
(已知Hg在溶液中,存在平衡:Hg-2e— Hg2+)
Hg2+)
(1)Cu2++H2S=CuS↓+2H+(2)B(3)2.4
(4)HgS的Ksp很小,发生反应Hg2++H2S=HgS↓+2H+,使Hg-2e— Hg2+正向移动,2H++2e—=H2↑(其他合理答案均可)
Hg2+正向移动,2H++2e—=H2↑(其他合理答案均可)
(1)硫化氢通入硫酸铜溶液中会发生复分解反应,反应方程式为H2S+CuSO4=CuS↓+H2SO4;
(2)H2S溶液中存在H2S HS-+H+,HS-
HS-+H+,HS- S2-+H+;A.加入少量的漂白粉,虽属于碱性物质,但漂白粉有强氧化性能氧化H2S,则c(OH-)增大,c(S2-)减小,故A错误;B.通入氨气,则平衡右移,c(OH-)、c(S2-)都增大,故B正确;C.加入少量过氧化钠粉末,能将硫离子氧化,硫离子浓度减小,故C错误;D.加入少量硝酸银溶液,会消耗硫离子,硫离子浓度减小,故D错误;故选B。
S2-+H+;A.加入少量的漂白粉,虽属于碱性物质,但漂白粉有强氧化性能氧化H2S,则c(OH-)增大,c(S2-)减小,故A错误;B.通入氨气,则平衡右移,c(OH-)、c(S2-)都增大,故B正确;C.加入少量过氧化钠粉末,能将硫离子氧化,硫离子浓度减小,故C错误;D.加入少量硝酸银溶液,会消耗硫离子,硫离子浓度减小,故D错误;故选B。
(3)溶液中c(S2-)=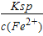 =6.25×10-18mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=
=6.25×10-18mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=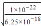 mol/L=4×10-3mol/L,pH=3-2lg2=2.4;
mol/L=4×10-3mol/L,pH=3-2lg2=2.4;
(4)已知Hg在溶液中,存在平衡:Hg-2e— Hg2+,HgS的Ksp很小,发生反应Hg2++H2S=HgS↓+2H+,使Hg-2e—
Hg2+,HgS的Ksp很小,发生反应Hg2++H2S=HgS↓+2H+,使Hg-2e— Hg2+正向移动, 2H++2e—=H2↑,故有氢气产生。
Hg2+正向移动, 2H++2e—=H2↑,故有氢气产生。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
