X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数
X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一 半,Y、Z、W原子的最外层电子数之和为14。
(1)XW4的空间构型为____,HWO的结构式为____,Z在元素周期表中的位置是____。
(2)①X、Y、Z、W原子半径由大到小依次是____(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是_________。(填化学式)。
(3)W同族上一周期元素单质不能把W元素从其钠盐的水溶液中置换出来,用化学方程式解释____________________。
(4)①家用“管道通”的有效成分是烧碱和Y的单质,使用时需加入一定量的水,此时发生反应的化学方程式为________________。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,写出灭火时发生反应的离子方程式_________。
(5)NW3是黄色油状液体,无漂白性,在热水中会发生水解。NW3的电子式为____。若取该液体滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色。写出NW3在热水中发生水解的化学方程式________________。
【答案】 正四面体 H-O-Cl 第三周期第ⅣA族 Al>Si>Cl>C HClO4>H2CO3>H2SiO3 2H2O+2F2=4HF+O2 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al3++3HCO3-=Al(OH)3↓+3CO2↑ 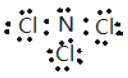 NCl3+3H2O=3HClO+NH3
NCl3+3H2O=3HClO+NH3
本题考查元素的推断,涉及分子的空间构型、结构式的书写、元素在周期表中的位置、原子半径大小的比较、化学方程式和离子方程式的书写。Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y为Al元素;Z为原子序数大于Y的短周期元素,Z原子的最外层电子数是次外层电子数的一半,Z为Si元素;X与Z位于同一主族,X为C元素;Y、Z、W原子的最外层电子数之和为14,W原子的最外层电子数为14-3-4=7,W为原子序数大于Z的短周期元素,W为Cl元素。
(1)XW4为CCl4,CCl4的空间构型为正四面体。HWO为HClO,HClO的结构式为H-O-Cl。Z为Si元素,Si为14号元素,Si位于第三周期第IVA族。
(2)①根据同周期主族元素从左到右原子半径依次减小,同主族从上到下原子半径依次增大,一般电子层数多原子半径大,则X、Y、Z、W原子半径由大到小的顺序为Al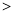 Si
Si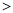 Cl
Cl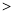 C。
C。
②非金属性:Cl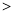 C
C Si,C、Si、Cl的最高价氧化物水化物酸性由强到弱依次为HClO4
Si,C、Si、Cl的最高价氧化物水化物酸性由强到弱依次为HClO4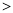 H2CO3
H2CO3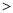 H2SiO3。
H2SiO3。
(3)W为Cl元素,W同族上一周期元素为F,F2不能从NaCl溶液中置换出Cl2是因为F2与溶剂水反应,反应的化学方程式为2F2+2H2O=4HF+O2。
(4)①Y为Al元素,加入一定量的水,Al与NaOH、H2O反应生成NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
②含Y元素的盐与小苏打溶液可用作泡沫灭火剂,含Y元素的盐为Al2(SO4)3,Al2(SO4)3溶液与NaHCO3溶液发生双水解反应生成Al(OH)3和CO2,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(5)NW3为NCl3,根据价键规则,NCl3的电子式为: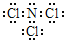 。NCl3滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,NCl3与热水反应生成HClO,NCl3在热水中发生水解的化学方程式为NCl3+3H2O=NH3+3HClO。
。NCl3滴入50℃左右的热水中,片刻后取该热水溶液滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,NCl3与热水反应生成HClO,NCl3在热水中发生水解的化学方程式为NCl3+3H2O=NH3+3HClO。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
