依据叙述,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为______________________________________________________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________________________________________________。
【答案】 CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1 N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1 N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+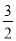 O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,故答案为:CH3OH(l)+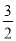 O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;
O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1;
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1;
(3)在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,反应为N2(g)+3H2(g)═2NH3(g)△H=-92kJ•mol-1,故答案为:N2(g)+3H2(g)═2NH3(g)△H=-92kJ•mol-1。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
