中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。
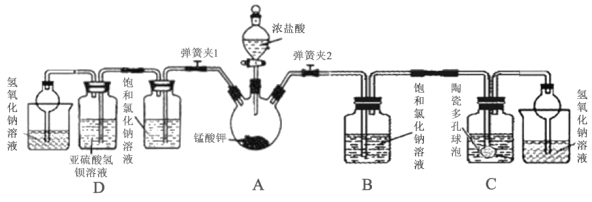
(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:____________。
(2)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因____________。
(3)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为____________;
②陶瓷多孔球泡的作用是____________。
(4)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+ IO3- ; IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为____________,达到滴定终点的标志是____________。
②该漂白粉中有效成分的质量分数为____________。
(5)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为____________ ,该现象能够证明氯气有氧化性。甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由____________。
【答案】(1)3K2MnO4+4 HCl =2KMnO4+ 4KCl +MnO2+2H2O;
2KMnO4 + 16HCl= 2KCl + 2MnCl2 + 5Cl2+ 8H2O;
(2)锰酸钾生成高锰酸钾与二氧化锰两种物质,形成均匀的固体分散系,可降低高锰酸钾与盐酸反应速率;
(3)①石灰乳;②增大气体接触面积,使氯气吸收更充分;
(4)①淀粉;最后一滴标准液滴下时,溶液变为浅蓝色,半分钟不褪色;②14.3%
(5)出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物
【解析】(1)根据现象,烧瓶壁有紫红色高锰酸钾生成,后逐渐消失,是与浓盐酸反应生成了氯气,烧瓶内有黑色固体二氧化锰残余,发生的化学反应方程式有3K2MnO4+4 HCl =2KMnO4+ 4KCl +MnO2+2H2O,2KMnO4 + 16HCl= 2KCl + 2MnCl2 + 5Cl2+ 8H2O,故答案为:3K2MnO4+4 HCl =2KMnO4+ 4KCl +MnO2+2H2O,2KMnO4 + 16HCl= 2KCl + 2MnCl2 + 5Cl2+ 8H2O;
(2)锰酸钾生成高锰酸钾与二氧化锰两种物质,形成均匀的固体分散系,可降低高锰酸钾与盐酸反应速率,使得反应缓和平稳许多,故答案为:锰酸钾生成高锰酸钾与二氧化锰两种物质,形成均匀的固体分散系,可降低高锰酸钾与盐酸反应速率;
(3)①工业上用石灰乳吸收氯气制备漂白粉,因此C中盛装石灰乳,故答案为:石灰乳;
②陶瓷多孔球泡可以增大气体接触面积,使氯气吸收更充分,故答案为:增大气体接触面积,使氯气吸收更充分;
(4)①反应中有碘生成,可以选用淀粉作指示剂,达到滴定终点现象为最后一滴标准液滴下时,溶液变为浅蓝色,半分钟不褪色,故答案为:淀粉;最后一滴标准液滴下时,溶液变为浅蓝色,半分钟不褪色;
②漂白粉中有效成分为次氯酸钙,根据方程式3ClO-+I-=3Cl-+ IO3- ;IO3-+5I-+3H2O=6OH-+3I2有Ca(ClO)2~2ClO-~4I-,n[Ca(ClO)2]=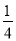 n(I-)=
n(I-)= 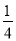 ×0.1000mol/L×0.02L=0.0005mol,该漂白粉中有效成分的质量分数为
×0.1000mol/L×0.02L=0.0005mol,该漂白粉中有效成分的质量分数为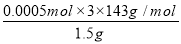 ×100%=14.3%,故答案为:14.3%;
×100%=14.3%,故答案为:14.3%;
(5)打开分液漏斗活塞及弹簧夹1,生成的氯气将亚硫酸钡氧化为硫酸钡沉淀;甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,不能证明氯气氧化了亚硫酸氢钡,因为氯气能够与水反应生成氯离子,故答案为:出现白色沉淀;不正确,氯气与水反应也生成氯离子,不能证明溶液中的氯离子一定是氯气氧化亚硫酸氢钡所得产物。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
