在一密闭气缸中,用一不漏气的滑动活塞隔开。常温时,左边充入1/4体积的N2,右边充入3/4体积的H2和O2的混合气。若右边气体点燃,反应后恢复到原温度,活塞停留在气缸正中,则原来混合气中H2和O2的体
在一密闭气缸中,用一不漏气的滑动活塞隔开。常温时,左边充入1/4体积的N2,右边充入3/4体积的H2和O2的混合气。若右边气体点燃,反应后恢复到原温度,活塞停留在气缸正中,则原来混合气中H2和O2的体积比是_______________。
【答案】4:5(氧气过量),7:2(氢气过量)
【解析】反应前:活塞两边气体温度、压强均相同,根据阿伏加德罗定律,右边混合气体的物质的量是N2的3倍。反应后:活塞两边气体温度、压强也均相同,根据阿伏加德罗定律,右边剩余气体的物质的量与N2相等。由于反应前后N2的体积虽然发生变化,但其物质的量没有改变,所以我们若假定N2为1mol时,H2和O2共3mol,反应后剩余气体即为1mol,假定参加反应的氢气和氧气分别为xmol和ymol,则
2H2+O2=2H2O 气体物质的量的减少
2 1 3
x y 3-1=2
显然:x=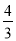 ,y=
,y=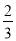 。x+y=2≠3,说明有气体剩余:
。x+y=2≠3,说明有气体剩余:
①若氢气有剩余,则氧气的物质的量为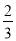 mol,氢气的物质的量为:
mol,氢气的物质的量为: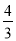 +1=
+1=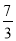 mol,即体积比等于物质的量之比为7:2。
mol,即体积比等于物质的量之比为7:2。
②若氧气有剩余,则氢气的物质的量为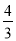 mol,氧气的物质的量为:
mol,氧气的物质的量为: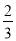 +1=
+1=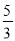 mol,即体积比等于物质的量之比为4:5。
mol,即体积比等于物质的量之比为4:5。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
