在Cu+2H2SO4(浓)<img alt="1" src="/tk/20210512/1620758143252.png"/>CuSO4+SO2↑
在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中
CuSO4+SO2↑+2H2O反应中
(1)__________元素被氧化,__________是氧化剂.
(2)用双线桥标出该反应电子转移的方向和数目
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)若有2.4mol的H2SO4参与反应,则被还原的H2SO4为__________g.
【答案】(1)铜;硫酸;
(2)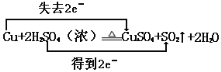 (3)117.6
(3)117.6
(1)在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O反应中铜元素的化合价由0价升高到+2价,被氧化,硫酸中的硫元素由+6价降低到+4价,被还原,硫酸是氧化剂,铜时还原剂,故答案为:铜;硫酸;
CuSO4+SO2↑+2H2O反应中铜元素的化合价由0价升高到+2价,被氧化,硫酸中的硫元素由+6价降低到+4价,被还原,硫酸是氧化剂,铜时还原剂,故答案为:铜;硫酸;
(2)铜元素的化合价由0价升高到+2价,失去的电子数为2,双线桥标出该反应电子转移的方向和数目: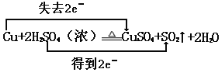 ,故答案为:
,故答案为: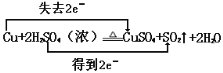 ;
;
(3)反应的硫酸中只有一半被还原,若有2.4mol的H2SO4参与反应,则被还原的H2SO4的物质的量为1.2mol,质量为1.2mol×98g/mol=117.6g,故答案为:117.6。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
