(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式______________________________
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式____________________________________。
(2)己知反应N2+3H2 2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
化学键 | H-H | N-H | N≡N |
键能kJ/mol | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
己知:C(s,石墨)+O2(g)=CO2(g) △Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) △H3=-2599kJ/mol
裉推盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:__________。
【答案】2CH3OH(1)+3O2(g)==2CO2(g)+4H2O⑴ △H=-1452.8 kJ/mol -93 △H=+226.7kJ/mol
【解析】(1)甲醇燃烧化学方程式为:2CH3OH+3O2(g) 2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为
2CO2(g)+4H2O,故2mol甲醇燃烧放出的热量为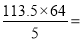 1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
1452.8kJ,故热化学方程式为:2CH3OH(1)+3O2(g)===2CO2(g)+4H2O(l) △H=-1452.8 kJ/mol
(2)△H=反应物的键能之和—生成物的键能之和=945+3×436—2×3×391=-93kJ/mol
(3)依据盖斯定律可知,2×①+②/2 —③/2:
2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7 kJ/mol
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
