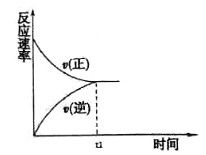
(1)在恒温恒压密闭容器中充入1mol N2和3 mol H2在tl时刻达到平衡状态后,继续充入2 mol NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系__________
(1)在恒温恒压密闭容器中充入1mol N2和3 mol H2在tl时刻达到平衡状态后,继续充入2 mol NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系__________________
(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是__________________
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6mol N-H键的同时,有3mol H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将amol/L的氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb__________________(写出详细计算过程)
【答案】 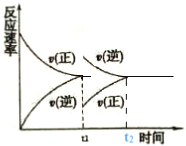 abde b×10-7/(a-b)
abde b×10-7/(a-b)
本题考查恒温恒压下的等效平衡规律,化学平衡的标志,电离平衡常数的计算。
(1)tl时刻达到平衡状态后,继续充入2 mol NH3,在恒温恒压容器中,逆反应速率突然变大,正反应速率突然变小,2molNH3采用一边倒极限换算后为1molN2和3molH2,在恒温恒压下达到的平衡与原平衡互为等效平衡,t2达到平衡时υ(正)和υ(逆)与原平衡相等,图像为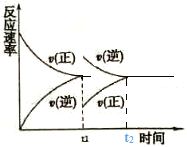 。
。
(2)合成氨的反应为N2+3H2 2NH3。a项,达到平衡时各组分的浓度不再发生变化,但不一定等于化学计量数之比,容器内N2、H2、NH3的浓度之比为1 : 3 : 2时各物质的浓度不一定保持不变,不一定是平衡状态;b项,υ(N2)(正)=3υ(H2)(逆),用N2表示的正反应速率与用H2表示的逆反应速率之比为3:1,不等于化学计量数之比,没有达到平衡状态;c项,恒温恒容时气体的压强与气体物质的量成正比,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,达到平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能作为平衡的标志;d项,混合气体的密度=
2NH3。a项,达到平衡时各组分的浓度不再发生变化,但不一定等于化学计量数之比,容器内N2、H2、NH3的浓度之比为1 : 3 : 2时各物质的浓度不一定保持不变,不一定是平衡状态;b项,υ(N2)(正)=3υ(H2)(逆),用N2表示的正反应速率与用H2表示的逆反应速率之比为3:1,不等于化学计量数之比,没有达到平衡状态;c项,恒温恒容时气体的压强与气体物质的量成正比,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,达到平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能作为平衡的标志;d项,混合气体的密度=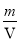 ,该反应中所有物质都是气体,气体总质量始终不变,恒容容器体积始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能作为平衡的标志;e项,单位时间内断裂6mol N-H键的同时一定有3molH-H形成,只描述了逆反应,不能作为平衡的标志;答案选abde。
,该反应中所有物质都是气体,气体总质量始终不变,恒容容器体积始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能作为平衡的标志;e项,单位时间内断裂6mol N-H键的同时一定有3molH-H形成,只描述了逆反应,不能作为平衡的标志;答案选abde。
(3)25℃时,氨水与盐酸混合后溶液呈中性,c(H+)=c(OH-)=1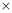 10-7mol/L;溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-)=
10-7mol/L;溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-)=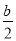 mol/L;根据N原子守恒,溶液中c(NH3·H2O)=
mol/L;根据N原子守恒,溶液中c(NH3·H2O)=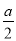 mol/L-
mol/L- mol/L=(
mol/L=(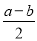 )mol/L,NH3·H2O的电离平衡常数Kb=
)mol/L,NH3·H2O的电离平衡常数Kb=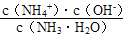 =
=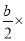 1
1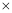 10-7
10-7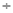 (
( )= b×10-7/(a-b)。
)= b×10-7/(a-b)。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
