A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
【答案】 碳 氮 氧 铝 第2周期第VIA族 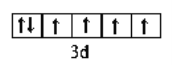 2p 纺锤形(或哑铃形) 2
2p 纺锤形(或哑铃形) 2  2
2 N3->O2->Al3+
N3->O2->Al3+ 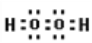
A元素基态原子的价电子排布式为nsnnpn,则n=2,所以A是碳元素;D元素简单离子是第三周期元素中离子半径最小的,则D是Al元素;C元素最外层电子数是电子层数的3倍,原子序数小于Al,则C是氧元素;元素B原子的核外p电子数比s电子数少1个,比铝的原子序数小,因此B是N;E元素价电子层中的未成对电子数为4,则E的价层电子排布是3d64s2,即为铁元素;
(1)根据以上分析可知,各元素的名称分别为:A为碳;B为氮,C为氧,D为铝;正确答案:碳;氮 ; 氧; 铝。
(2)C元素为氧,核电荷数为8,位于周期表第2周期第VIA族;E为铁,核电荷数为26,Fe2+价电子的轨道表示式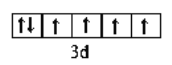 ;B为氮,核外电子排布为1s2 2s2 2p3,因此能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形)形。正确答案:第2周期第VIA族;
;B为氮,核外电子排布为1s2 2s2 2p3,因此能量最高的电子为2p轨道上的电子,其轨道呈纺锤形(或哑铃形)形。正确答案:第2周期第VIA族;  ;2p; 纺锤形(或哑铃形)。
;2p; 纺锤形(或哑铃形)。
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物为二氧化碳,为共价化合物,碳氧之间为双键,因此1mol二氧化碳分子中含有σ键有2 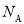 个;π键有2
个;π键有2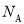 个;正确答案:2
个;正确答案:2 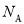 ; 2
; 2 。
。
(4)B、C、D的简单离子分别为N3-、O2-、Al3+,核外电子排布相同的离子,核电荷数越大,离子半径越小,因此离子半径由大到小的顺序为N3->O2->Al3+;正确答案:N3->O2->Al3+。
(5)氧元素的核外有18个电子的氢化物是双氧水,属于共价化合物,电子式为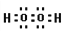 ;正确答案:
;正确答案: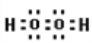 。
。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
