二氧化碳的捕集与利用是实现温室气体减排的重要途径之一。
(1)目前工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3=___________(用含ΔH1、ΔH2的代数式表示)。
(2)利用CO2制备乙烯是我国能源领域的一个重要战略方向,具体如下:
方法一:CO2催化加氢合成乙烯,其反应为
2CO2(g)+6H2(g)  C2H4(g)+4H2O(g) ΔH=a kJ·mol-1
C2H4(g)+4H2O(g) ΔH=a kJ·mol-1
起始时按n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时的H2和H2O的物质的量如图甲所示:
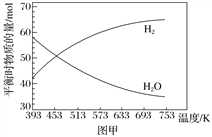
①下列说法正确的是________;
A.该反应正反应的活化能小于逆反应的活化能
B.其他条件不变时,若扩大容器容积,则活化分子百分数增大,v正和v逆均增大
C.测得容器内混合气体平均分子量不随时间改变时,说明反应已达到平衡
D.使用合适的催化剂,可以改变反应历程,减小反应焓变,加快反应速率
②393 K下,H2的平衡转化率为________(保留三位有效数字);
③393 K下,该反应达到平衡后,再向容器中按n(CO2)∶n(H2)=1∶3投入CO2和H2则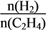 将_________(填“变大”“不变”“变小”或“无法确定”);
将_________(填“变大”“不变”“变小”或“无法确定”);
方法二:用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图乙所示。
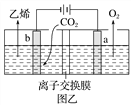
④b电极上的电极反应式为_______________________________________________________;
⑤该装置中使用的是________(填“阳”或“阴”)离子交换膜。
【答案】2ΔH2-ΔH1 AC 67.4% 变小 2CO2+12e-+12H+===C2H4+4H2O 阳
【解析】(1)反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq)△H2
根据盖斯定律Ⅱ×2-Ⅰ可得:(NH4)2CO3(aq)+H2O (l)+CO2(g)⇌2NH4HCO3(aq)△H3=2△H2-△H1,故答案为:2△H2-△H1;
(2)①A.使用催化剂,可降低反应活化能,加快反应速率,故A正确;B.其它条件不变时,若扩大容器容积,则U正减小,v逆减小,故B错误;C.反应前后气体物质的量减小,气体质量不变,测得容器内混合气体平均分子量不随时间改变时,说明反应已达到平衡,故C正确;D.反应使用合适的催化剂,催化剂改变反应历程加快反应速率,不改变化学平衡,不改变反应焓变,故D错误;故答案为:AC;
②图象分析可知,393K时平衡状态下水的物质的量为58mol,结合化学平衡三行计算列式,设起始量二氧化碳和氢气分别为amol,3amol,
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
初起:a3a00
变化:293a-42=8714.558
平衡:a-2942 14.558
所以a=43,转化率=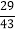 ×100%=67.4%,故答案为:67.4%;
×100%=67.4%,故答案为:67.4%;
③393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,相当于增大压强,平衡正向移动,所以则n(H2)/n(C2H4)将变小,故答案为:变小;
④电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O;
⑤离子交换只允许氢离子通过,所以是阳离子交换膜,故答案为:阳。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
