工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:<br/>①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1<br/>②CO(g)+2
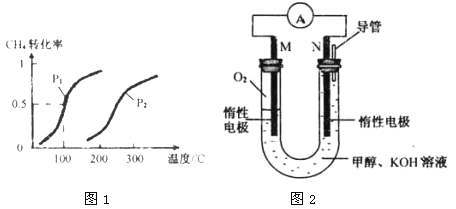
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1②CO(g)+2H2(g)⇌CH3OH(g)△H2请按要求回答下列问题:(1)将0.20molCH4和0.30molH2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如图1.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)______ ;△H1______ 0,pl p2(均填“<”、“=”或“>”);pl、100°C时平衡常数的值K=______ .(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.
实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
Ⅰ | 150 |
| 0.1 |
Ⅱ | ______ | ______ | 5 |
Ⅲ | 300 | ______ | ______ |
 若在300°C时其他条件不变,将该反应容器容积压缩到原来的l/2,重新平衡时CH3OH的物质的量的变化是______ ,K的变化是______ (均填“增大”,“减小”或“不变”).(3)已知在常温常压下:2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/molH2O(g)=H2O(I)△H=﹣44.0kJ/mol,请计算32g新型燃料甲醇完全燃烧生成液态水放出热量为______ kJ.(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如图2所示,电池工作时电子移动方向是(极板用M、N表示)______ ,负极电极反应式为 ______ .若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到1.12L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=______ (假设反应前后溶液体积不变).
若在300°C时其他条件不变,将该反应容器容积压缩到原来的l/2,重新平衡时CH3OH的物质的量的变化是______ ,K的变化是______ (均填“增大”,“减小”或“不变”).(3)已知在常温常压下:2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/molH2O(g)=H2O(I)△H=﹣44.0kJ/mol,请计算32g新型燃料甲醇完全燃烧生成液态水放出热量为______ kJ.(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如图2所示,电池工作时电子移动方向是(极板用M、N表示)______ ,负极电极反应式为 ______ .若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到1.12L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=______ (假设反应前后溶液体积不变).
增大;>;<;3.375×10﹣2 ;150; ;
; ;5(或0.1);增大;不变;725.8;从N极经导线流向M极;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;13
;5(或0.1);增大;不变;725.8;从N极经导线流向M极;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;13
(1)温度不变,缩小体积即增大压强,根据压强对反应速率的影响,增大压强,正逆反应速率都增大;由图1可知:升高温度时,CH4的转化率增大,说明平衡向正方向移动,而升高温度,平衡移动的方向是吸热方向,所以△H1>0;对于反应①,增大压强时,平衡向逆方向移动,CH4的转化率减小,从图中可看出:温度相同时,压强为P2的CH4的转化率小,说明P1<P2;由图1可知,由100℃平衡CH4的转化率为50%,则转化的CH4为0.2mol×50%=0.1mol,甲烷的浓度变化量为  =0.05mol/L,则:
=0.05mol/L,则:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始浓度(mol/L):0.1 0.15 0 0
变化浓度(mol/L):0.05 0.05 0.05 0.15
平衡浓度(mol/L):0.05 0.1 0.05 0.15
所以,100℃时平衡常数k 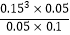 =3.375×10﹣2 .
=3.375×10﹣2 .
所以答案是:
增大;>;<;3.375×10﹣2 ;
(2)通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n (CO)/n(H2)为 , Ⅲ中n (CO)/n(H2)为
, Ⅲ中n (CO)/n(H2)为 , 压强为5(或0.1);
, 压强为5(或0.1);
其他条件不变,压缩体积即增大压强,即向正反应移动,甲醇的物质的量增加;温度不变,平衡常数也不变;
所以答案是:
实验Ⅱ:150 
实验Ⅲ: 5(或0.1)
5(或0.1)
增大;不变;
(3)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②H2O(g)=H2O(l)△H=﹣44.0kJ/mol
由盖斯定律,①+②×4得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),故△H=﹣1275.6kJ∕mol+(﹣44.0kJ/mol)×4=﹣1451.6kJ∕mol,
所以,新型燃料甲醇完全燃烧生成液态水的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣1451.6 kJ∕mol,
32g甲醇的物质的量为1mol,故放出的热量为725.8kJ.
所以答案是:725.8;
(4)根据原电池原理,电子从负极流向正极,而燃料电池正极通入的是氧气,负极通入的是燃料,故电池工作时电子移动方向是从N极经导线流向M极;燃料电池负极发生的是失电子的氧化反应,生成CO2和水,CO2与OH﹣结合成
CO32﹣ , 所以负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
电解饱和食盐水的电解方程式为:2NaCl+2H2O=Cl2↑+H2↑+2NaOH,标况下1.12L气体的物质的量为0.05mol,所以生成的Cl2和H2的物质的量均为0.025mol,则n(OH﹣)=0.025mol×2=0.05mol,C(OH﹣)=  =0.1mol/L,所以,c(H+)=10﹣13mol/L,pH=13.
=0.1mol/L,所以,c(H+)=10﹣13mol/L,pH=13.
所以答案是:从N极经导线流向M极;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;13.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!

