H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.<br/>(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1mol•L﹣1 Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______②设计实验方案:在不同H2O2浓度下,测定______(要求所测得的数据能直接体现反应速率大小).③设计实验装置,完成如1图所示的装置示意图.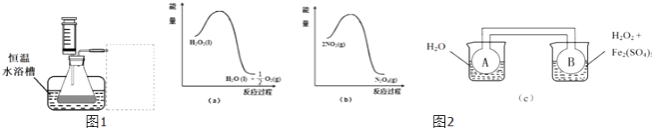 ④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
实验序号 物理量 | V[0.1mol•L﹣1 Fe2(SO4)3]/mL | ______ | ______ | ______ | ______ |
1 | a | ______ | ______ | ______ | ______ |
2 | a | ______ | ______ | ______ | ______ |
(2)利用图2(a)和2(b)中的信息,按图2(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的______(填“深”或“浅”),其原因是______ .
【答案】(1)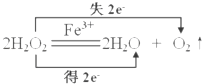 ;相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;V(30% H2O2)/Ml;V(蒸馏水)/mL;时间t/min;V(氧气)/mL;b;c;d;m;c;b;d;a
;相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少;V(30% H2O2)/Ml;V(蒸馏水)/mL;时间t/min;V(氧气)/mL;b;c;d;m;c;b;d;a
(2)深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深
【解析】实验序号
V[0.1mol•L﹣1 Fe2(SO4)3]/mL
V(30% H2O2)/mL
V(蒸馏水)/mL
时间t/min
V(氧气)/mL
1
a
b
c
d
m
2
a
c
b
d
n
所以答案是:
实验序号
V[0.1mol•L﹣1 Fe2(SO4)3]/mL
V(30% H2O2)/mL
V(蒸馏水)/mL
时间t/min
V(氧气)/mL
1
a
b
c
d
m
2
a
c
b
d
n
;(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)⇋N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,所以答案是:深;2NO2(红棕色)⇋N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
