实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如图1所示). <img alt="1" src
实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如图1所示). 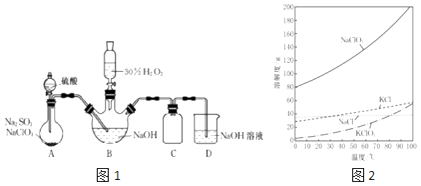
已知(如图2):(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3•3H2O,高于38℃时析出晶体是NaClO2;(Ⅱ)30% H2O2超过40℃时会完全分解;(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl.
(1)图1装置A发生的反应中,还原剂是______ .
(2)图1装置B中反应生成NaClO2的化学方程式为______ . ②实验中图1装置B需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有______、______ .
(3)请补充从图1装置B反应后的溶液中获得NaClO2晶体的操作步骤. ①在55℃ 时蒸发结晶;②______;③______;④______;得到成品.
(4)图1装置C的作用是______ .
(5)证明实验后图1装置B所得混合溶液中的NaClO2具有氧化性的实验方案是______ . (可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
【答案】(1)Na2SO3
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;缓慢滴加硫酸、H2O2;装置B加冷水浴等
(3)趁热(不低于38℃)过滤;用38~60℃热水洗涤;低于60℃干燥
(4)防止D中的溶液倒吸到B瓶(或安全瓶)中
(5)混合溶液加热至40℃至60℃之间除去H2O2 , 冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性
【解析】(1)A装置的反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,Na2SO3中硫元素化合价升高,被氧化,做还原剂;所以答案是:Na2SO3;(2)①B装置为ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2 , 化学方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
所以答案是:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;②实验中图1装置B需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有缓慢滴加硫酸、H2O2、装置B加冷水浴等;
所以答案是:缓慢滴加硫酸、H2O2、装置B加冷水浴等;(3)已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3•3H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl,从图1装置B反应后的溶液中获得NaClO2晶体的操作步骤为:在55℃时蒸发结晶,趁热(不低于38℃)过滤;用38~60℃热水洗涤;低于60℃干燥,得到成品;
所以答案是:趁热(不低于38℃)过滤;用38~60℃热水洗涤;低于60℃干燥;(4)C装置为安全瓶,防止D中的溶液倒吸到B瓶中;
所以答案是:防止D中的溶液倒吸到B瓶(或安全瓶)中;(5)装置B所得混合溶液中的NaClO2混有H2O2 , 验证NaClO2具有氧化性,需先将H2O2除去,再用亚铁离子检验,实验方案是:装置B所得混合溶液加热至40℃至60℃之间除去H2O2 , 冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性;
所以答案是:混合溶液加热至40℃至60℃之间除去H2O2 , 冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
