硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
实验步骤:
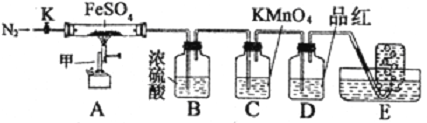
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
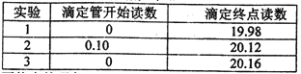
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
【答案】(1)酒精喷灯;
(2)吸收分解产生的SO3;
(3)5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)将装置内残留的气体排入吸收装置中完全吸收,同时防止发生倒吸;
(5)①溶液由浅紫色(或浅红色)变成无色,且半分钟不恢复成浅紫色;
②8FeSO4 4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑
4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑
(6)将反应后的固体转移至小烧杯中,加入少量水,搅拌,过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明FeSO4没有完全分解,反之则分解完全。(其他合理答案均可)
【解析】(1)仪器甲为酒精喷灯,故答案为:酒精喷灯;
(2)硫酸亚铁分解生成二氧化硫和三氧化硫和氧化铁,B中浓硫酸可以吸收分解产生的SO3,故答案为:吸收分解产生的SO3;
(3)二氧化硫具有还原性,能够被高锰酸钾氧化,C中发生反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,继续通入一段时间N2,可以将装置内残留的气体排入吸收装置中完全吸收,同时防止发生倒吸,故答案为:将装置内残留的气体排入吸收装置中完全吸收,同时防止发生倒吸;
(5)①高锰酸钾溶液呈紫色,滴定终点的现象为溶液由浅紫色(或浅红色)变成无色,且半分钟不恢复成浅紫色,故答案为:溶液由浅紫色(或浅红色)变成无色,且半分钟不恢复成浅紫色;
②E中收集的气体,能够使带火星的木条复燃,说明还生成了氧气。FeSO4分解的化学方程式为8FeSO4 4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑,故答案为:8FeSO4
4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑,故答案为:8FeSO4 4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑。
4Fe2O3+ 6SO2↑+ 2SO3↑+ O2↑。
(6)检验A中的FeSO4是否完全分解,只要检验是否存在亚铁离子即可,故答案为:将反应后的固体转移至小烧杯中,加入少量水,搅拌,过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明FeSO4没有完全分解,反之则分解完全。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
