硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示(固定装置及夹持装置略去):
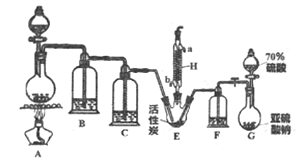
已知:
①SO2(g)+Cl2(g)=SO2Cl2 (l) △H=-97kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃ 以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)检验装置G气密性的方法是_________。
(2)装置A中发生反应的离子方程式为_______________。
(3)硫酰氯在潮湿空气中“发烟”的原因是__________(用化学方程式表示)。
(4)H的作用是________,其中水流的方向是_____→______(填a或b) 。
(5)装置C、F中的试剂相同,盛放的试剂为_____________。
(6)该装置存在的一处缺陷是______________。
(7)若将SO2、Cl2按照一定比例通入水中,请设计简单实验脸证二者是否恰好完全反应(简要描述实验步骤、现象和结论):______________.供选择试剂:滴加酚酞的NaOH溶液、FeCl2溶液、KSCN溶液、品红溶液。
【答案】 关闭止水夹,打开分液漏斗活塞,向分液漏斗中加水,一段时间后,若水不能顺利流下,证明气密性良好 MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑+ 2H2O SO2Cl2+2H2O=H2SO4+2HCl 冷凝、回流 b a 浓硫酸 E装置中未反应完全的气体没有进行尾气处理,污染环境 取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色则二者未反应完全,若不褪色则二者恰好完全反应
Mn2+ + Cl2↑+ 2H2O SO2Cl2+2H2O=H2SO4+2HCl 冷凝、回流 b a 浓硫酸 E装置中未反应完全的气体没有进行尾气处理,污染环境 取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色则二者未反应完全,若不褪色则二者恰好完全反应
(1)G装置中含有分液漏斗,则检验装置G气密性的方法是关闭止水夹,打开分液漏斗活塞,向分液漏斗中加水,一段时间后,若水不能顺利流下,证明气密性良好;(2)装置A制备氯气,其中发生反应的离子方程式为MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑+ 2H2O;(3)硫酰氯易水解:SO2Cl2 +2H2O = H2SO4+2HCl,HCl结合水蒸汽形成白雾,造成硫酰氯在潮湿空气中易“发烟”; (4)根据装置图,装置H是冷凝管,主要是冷凝回流;由于需要逆向冷却,则其中水流的方向是b→a;(5)C为除去氯气中的水蒸气,因此C中盛放浓硫酸,F为干燥二氧化硫的装置,可以选用浓硫酸;(6)氯气和二氧化硫均能够污染空气,该装置中末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽也易进行装置E内,故答案为:末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽易进行装置内。(7)若将SO2、Cl2按照一定比例通入水中,如果恰好完全反应,则生成氯化氢和硫酸,无论有谁过量,溶液都会有漂白性,所以验证二者是否恰好完全反应的方法是检验其漂白性,即取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色则二者未反应完全,若不褪色则二者恰好完全反应。
Mn2+ + Cl2↑+ 2H2O;(3)硫酰氯易水解:SO2Cl2 +2H2O = H2SO4+2HCl,HCl结合水蒸汽形成白雾,造成硫酰氯在潮湿空气中易“发烟”; (4)根据装置图,装置H是冷凝管,主要是冷凝回流;由于需要逆向冷却,则其中水流的方向是b→a;(5)C为除去氯气中的水蒸气,因此C中盛放浓硫酸,F为干燥二氧化硫的装置,可以选用浓硫酸;(6)氯气和二氧化硫均能够污染空气,该装置中末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽也易进行装置E内,故答案为:末端没有尾气处理装置和干燥装置,污染大、外界水蒸汽易进行装置内。(7)若将SO2、Cl2按照一定比例通入水中,如果恰好完全反应,则生成氯化氢和硫酸,无论有谁过量,溶液都会有漂白性,所以验证二者是否恰好完全反应的方法是检验其漂白性,即取少量反应后的溶液于试管中,滴加品红溶液振荡,若溶液褪色则二者未反应完全,若不褪色则二者恰好完全反应。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
