在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(mol•L﹣1)随时间(min
在一恒容密闭容器中发生某化学反应2A(g)⇌B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(mol•L﹣1)随时间(min)的变化如图所示,请回答:
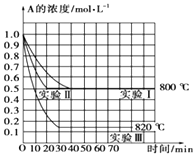
(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为______mol•L﹣1•min﹣1 .
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是______
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向______(填“正”或“逆”)反应方向移动,该正反应是______(填“放热”或“吸热”)反应.
【答案】(1)0.0125
(2)实验Ⅱ使用了催化剂
(3)逆;吸热
【解析】解:(1)实验Ⅰ中,反应在0min至40min内A的浓度变化为1mol/L﹣0.5mol/L=0.5mol/L,所以v(A)= 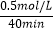 =0.0125 mol•L﹣1•min﹣1 , 所以答案是:0.0125mol•L﹣1•min﹣1;(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂,所以答案是:实验Ⅱ使用了催化剂;(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
=0.0125 mol•L﹣1•min﹣1 , 所以答案是:0.0125mol•L﹣1•min﹣1;(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂,所以答案是:实验Ⅱ使用了催化剂;(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
所以答案是:逆;吸热.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
