高温下用H2还原CuCl制备活性铜,反应原理如下:
2Cu(s)+Cl2(g)  2CuCl(s)ΔH1=-36 kJ·mol-1①
2CuCl(s)ΔH1=-36 kJ·mol-1①
H2(g)+2CuCl(s)  2Cu(s)+2HCl(g)ΔH2②
2Cu(s)+2HCl(g)ΔH2②
有关物质的键能数据如下表:
物质 | H2 | Cl2 | HCl |
键能/kJ·mol-1 | 436 | 243 | 432 |
(1)ΔH2=________kJ·mol-1。
(2)经测定反应②制备活性铜的反应趋势大,原因是__________。
(3)在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),在图中画出Cl2浓度的变化趋势线。________________________

(4)白色不溶于水的CuCl可以由电解法制得,如图所示:
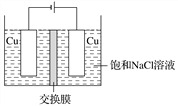
①装置中用的交换膜为________。
A.阳离子交换膜 B.阴离子交换膜
C.质子交换膜 D.氢氧根离子交换膜
②阳极的电极反应式为______________________________________________。
(5)已知CuCl可溶解于稀硝酸,写出该反应的化学方程式:
________________________________________________________________________。
(6)根据已学知识写出制取CuCl的一种方法,用化学方程式表示:____________________________。
【答案】 -149 正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应 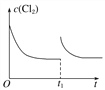 (平衡线与原平衡线相平) A Cu+Cl--e-===CuCl 6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O CuCl2+Cu
(平衡线与原平衡线相平) A Cu+Cl--e-===CuCl 6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O CuCl2+Cu 2CuCl
2CuCl
(1) 根据表格数据可知,③H2(g)+ Cl2(g)= 2HCl(g) ΔH,3=(436 kJ·mol-1)+(243 kJ·mol-1)-(432 kJ·mol-1)×2=-185kJ·mol-1,①2Cu(s)+Cl2(g)  2CuCl(s)ΔH1=-36 kJ·mol-1,根据盖斯定律,将③-①得:H2(g)+2CuCl(s)
2CuCl(s)ΔH1=-36 kJ·mol-1,根据盖斯定律,将③-①得:H2(g)+2CuCl(s)  2Cu(s)+2HCl(g)ΔH2=ΔH,3-ΔH1=(-185kJ·mol-1)-(-36 kJ·mol-1)=-149 kJ·mol-1,故答案为:-149;
2Cu(s)+2HCl(g)ΔH2=ΔH,3-ΔH1=(-185kJ·mol-1)-(-36 kJ·mol-1)=-149 kJ·mol-1,故答案为:-149;
(2)反应②的正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应,因此制备活性铜的反应趋势大,故答案为:正反应ΔH<0,ΔS>0,是自发反应,逆反应为非自发反应;
(3) 在某温度下,反应①达到平衡状态,在tl时,增加压强到原来的2倍(Cu的量足够),反应速率增大,平衡正向移动,但平衡常数不变,达到新平衡是氯气的浓度不变,Cl2浓度的变化趋势线为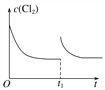 ,故答案为:
,故答案为: ;
;
(4)①阳极铜失去电子生成亚铜离子,生成的亚铜离子与氯离子结合生成白色不溶于水的CuCl,阳极区多余的钠离子向阴极区移动,因此装置中用的交换膜为阳离子交换膜,故选A;
②根据上述分析,阳极的电极反应式为Cu+Cl--e-=CuCl,故答案为:Cu+Cl--e-=CuCl;
(5)CuCl溶解于稀硝酸,发生氧化还原反应,反应的化学方程式为6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O,故答案为:6CuCl+8HNO3===3Cu(NO3)2+3CuCl2+2NO↑+4H2O;
(6) CuCl中的铜为+1价,可以由铜离子与铜反应生成,反应的化学方程式为CuCl2+Cu 2CuCl,故答案为:CuCl2+Cu
2CuCl,故答案为:CuCl2+Cu 2CuCl。
2CuCl。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
