某温度下,在一密闭容器中发生可逆反应:2E(g)<img alt="1" src="/tk/20210512/1620749300877.png"/>
某温度下,在一密闭容器中发生可逆反应:2E(g) F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
【答案】B
【解析】A. 升高温度正、逆反应速率都增大,故A错误;
B. 容器体积保持不变,x=1反应前后气体的物质的量不变,若E的起始浓度改为2amol/L,等效为增大压强,平衡不移动,平衡时E的转化率不变,新平衡下E的体积分数与原平衡相等为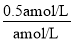 ×100%=50%,故B正确;
×100%=50%,故B正确;
C. 原平衡时E浓度为0.5amol/L,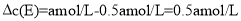 故平衡时F的浓度为0.5amol/L,容器体积保持不变,若E的起始浓度改为2amol/L,等效为在原平衡的基础上增大2mol/LE的浓度,反应向正反应进行,F的浓度增大,故大于0.5amol/L,故C错误;
故平衡时F的浓度为0.5amol/L,容器体积保持不变,若E的起始浓度改为2amol/L,等效为在原平衡的基础上增大2mol/LE的浓度,反应向正反应进行,F的浓度增大,故大于0.5amol/L,故C错误;
D. 容器压强保持不变,若E的起始浓度改为2amol/L,与原平衡为等效平衡,E的转化率相同,平衡时E的物质的量为原平衡的2倍,题目中为物质的量的浓度,不能确定物质的量,原平衡E的物质的量不一定是0.5amol,故D错误;
答案选B。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
下一篇 :返回列表
