前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于第四周期的金属元素,基态C、F原子的价电子层中未成对电子均
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于第四周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,C位于s区且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且位于同一族原子序数相差为2。
(1)六种元素中第一电离能最小的是__________(填元素符号,下同),电负性最大的是__________。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式__________,1molAB+中含有π键的数目为____________,黄血盐晶体中各种微粒间的作用力不涉及__________(填序号)。
a.离子键b.共价键c.配位键
d.金属键e.氢键f.分子间的作用力
(3)E2+的价层电子排布图为____________,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为____________,它与氢气的加成产物熔、沸点比CH4的熔、沸点高,其主要原因是______________________________________(须指明加成产物是何物质)。
K N K4[Fe(CN)6] 2NA def 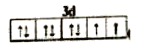 ①③④ 平面三角形 加成产物为CH3OH,分子之间可以形成氢键,导致物质熔沸点反常的高
①③④ 平面三角形 加成产物为CH3OH,分子之间可以形成氢键,导致物质熔沸点反常的高
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni。
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1molCN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为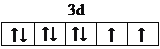 ;①CH2=CH2、③
;①CH2=CH2、③ 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,故答案为:
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,故答案为: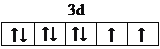 ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键,导致物质熔沸点反常的高。
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键,导致物质熔沸点反常的高。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
