水合肼(N2H4 . H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl.据此,某学生设计了下列实验.
水合肼(N2H4 . H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl.据此,某学生设计了下列实验.
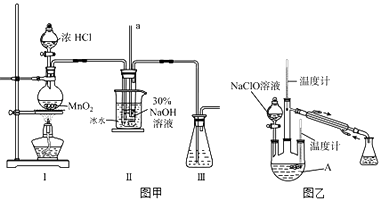
(1)【制备NaClO溶液】实验装置如图甲所示(部分夹持装置已省略)
已知:3NaClO  2NaCl+NaClO3
2NaCl+NaClO3
(i)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填字母).
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(ii)装置工中发生的离子反应方程式是______;Ⅱ中玻璃管a的作用为______;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的______
(2)【制取水合肼】实验装置如图乙所示
仪器A的名称为______;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4•H2O参与A中反应并产生大量氮气,产品产率因此降低,请
写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品.
(3)【测定肼的含量】
称取馏分0.3000g,加水配成20.0mL溶液,在一定条件下,用0.1500mol•L﹣1 的I2溶液滴定.
已知:N2H4•H2O+2I2=N2↑+4Hl+H2O.
①滴定时,可以选用的指示剂为______;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4 . H2O的质量分数为______ .
【答案】(1)BD;MnO2+4H++2Cl﹣ Mn2+Cl2↑+2H2O;平衡压强;饱和食盐水;防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率
Mn2+Cl2↑+2H2O;平衡压强;饱和食盐水;防止NaClO(歧化)分解为氯酸钠和氯化钠,影响水合肼的产率
(2)三颈烧瓶;N2H4?H2O+2NaClO=N2↑+3H2O+2NaCl
(3)淀粉溶液;25%
【解析】N2H4•H2O+
2I2
=
N2↑+
4HI+
H2O
50g
2mol
0.3000g×a
0.020L×0.15mol/L
所以50g:0.3000g×a=2mol:0.020L×0.15mol/L,解得:a=25%,所以答案是:25%.
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
