以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是______ , 该反应自发进行的条件 ______。
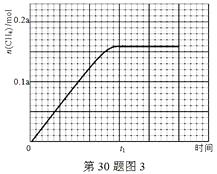
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)  CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)  CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
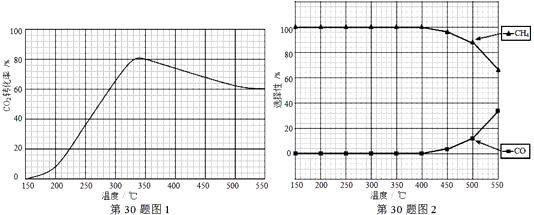
①下列说法不正确的是______
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为______(用a、V表示)
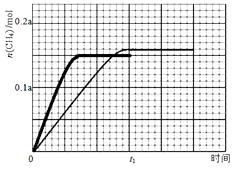
(3)350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
(4)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 ______。
【答案】(1)Al2O3(s)+ 3C(s)+ N2(g)===2Al(g) +3CO(g)+ 2AlN(s),ΔH=+1026 kJ·molˉ1;高温
(2)CD;625V2/a2
(3)
(4)CO2+ 6H2O +8eˉ === 6CH4+ 8OHˉ
【解析】CO2(g)+
4H2(g) 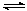
CH4(g)+
2H2O(g)
初n
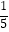 a
a
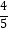 a
a
0
0
转化n
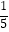 a ×0.8
a ×0.8
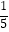 a ×0.8×4
a ×0.8×4
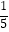 a ×0.8
a ×0.8
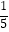 a ×0.8×2
a ×0.8×2
平衡n
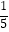 a ×0.2
a ×0.2
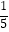 a ×0.8
a ×0.8
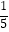 a ×0.8
a ×0.8
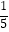 a ×1.6
a ×1.6
代入求平衡常数K=[ 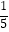 a ×0.8×(
a ×0.8×( 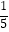 a ×1.6)2×
a ×1.6)2× 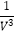 ]/[
]/[ 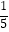 a ×0.2×(
a ×0.2×( 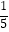 a ×0.8)4×
a ×0.8)4× 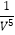 ]=625V2/a2(要除以体积转化为浓度之后代入)t1时350℃达到平衡,反应为放热反应,400℃反应速率加快,平衡逆移动,后生成甲烷的量减少。
]=625V2/a2(要除以体积转化为浓度之后代入)t1时350℃达到平衡,反应为放热反应,400℃反应速率加快,平衡逆移动,后生成甲烷的量减少。
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
